Содержание
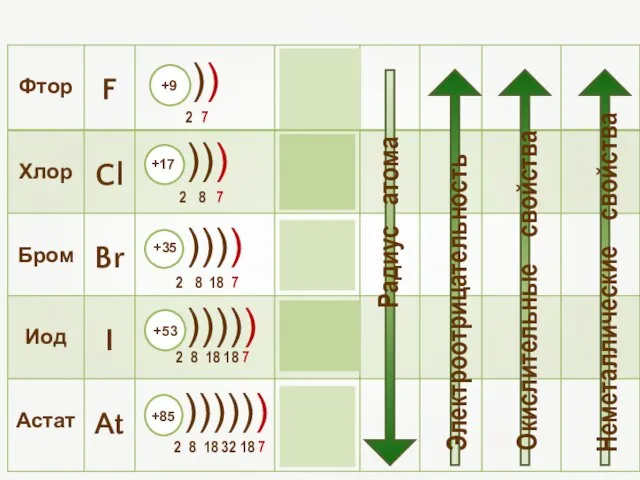
- 2. Общая характеристика элементов VIIa группы От F к At (сверху вниз в периодической таблице) происходит: увеличение:
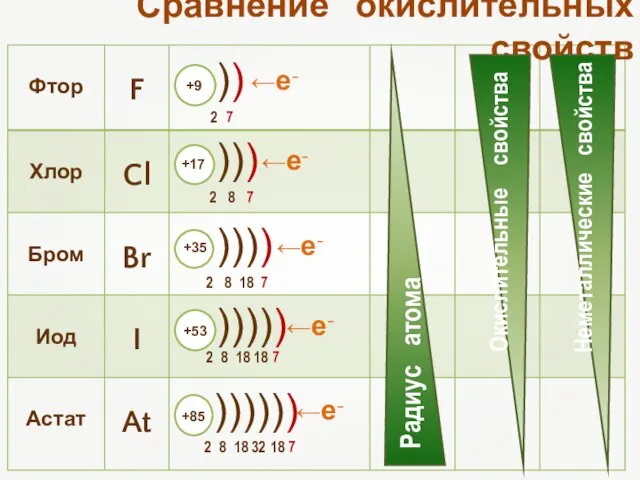
- 4. Сравнение окислительных свойств ←е- ←е- ←е- ←е- ←е-
- 5. Физические свойства Галогены (греч. hals - соль + genes - рождающий) - химические элементы VIIa группы:
- 6. Природные соединения NaCl - галит (каменная соль) CaF2 - флюорит, плавиковый шпат NaCl*KCl - сильвинит 3Ca3(PO4)2*CaF2
- 7. Получение В промышленности: электролизом водных растворов и расплавов их солей. 2NaCl + 2H2O → 2NaOH +
- 8. С простыми веществами: С МЕталлами С Неметаллами 2Na + F2 → 2NaF H2 + F2 →
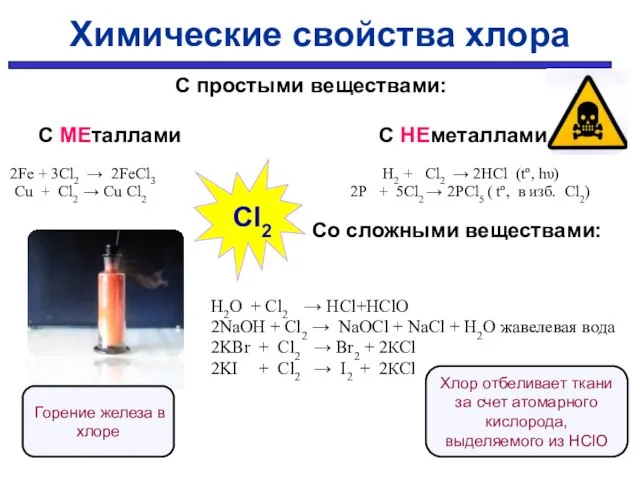
- 9. С простыми веществами: С МЕталлами С НЕметаллами 2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 →
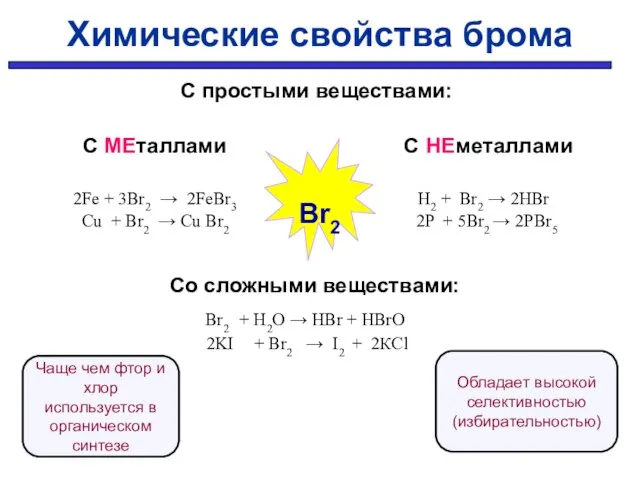
- 10. С простыми веществами: С МЕталлами С НЕметаллами 2Fe + 3Br2 → 2FeBr3 H2 + Br2 →
- 11. С простыми веществами: С металлами С неметаллами Hg + I2 → HgI2 H2 + I2 →
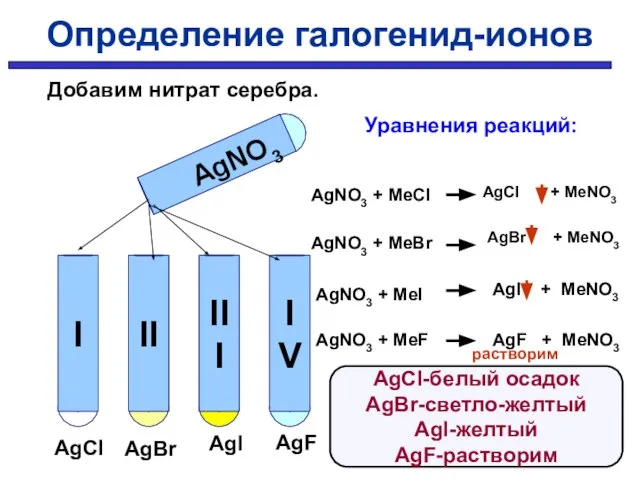
- 12. Определение галогенид-ионов Определить в какой пробирке находится раствор хлорида, бромида, иодида, фторида ?
- 14. AgNO3 AgCl AgBr AgI AgF Уравнения реакций: AgNO3 + MeCl AgNO3 + MeBr AgNO3 + MeI
- 15. Соединения галогенов Галогеноводороды — бесцветные газы, с резким запахом, токсичны. Н2 + F2 = 2HF H2
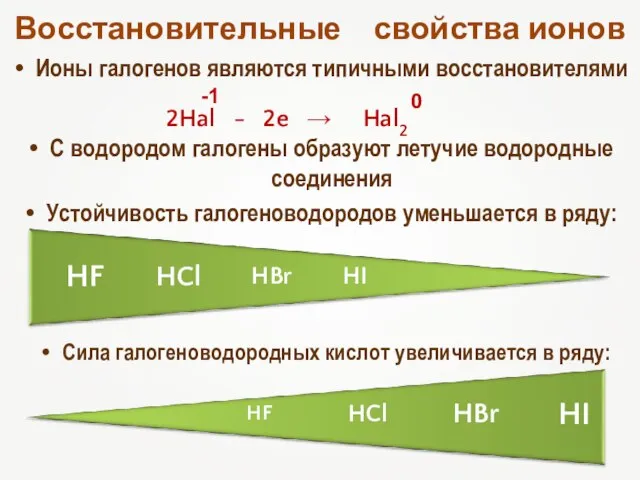
- 16. Восстановительные свойства ионов Ионы галогенов являются типичными восстановителями С водородом галогены образуют летучие водородные соединения Устойчивость
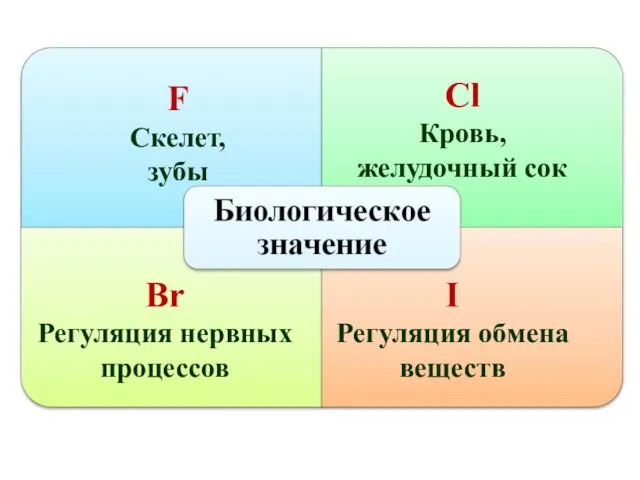
- 17. F Скелет, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ
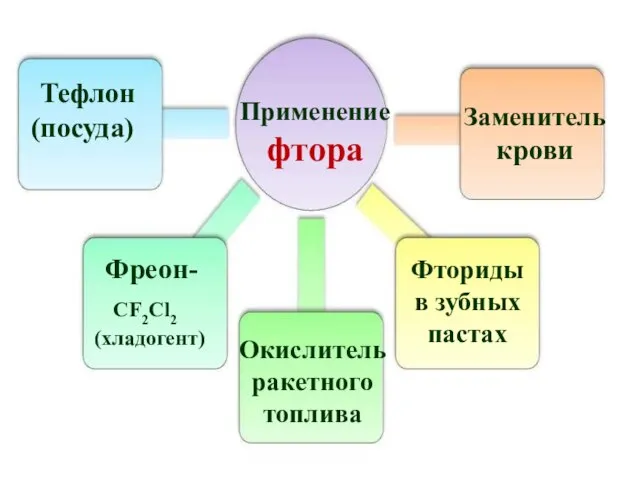
- 18. Применение фтора Тефлон (посуда) Фреон- CF2Cl2 (хладогент) Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
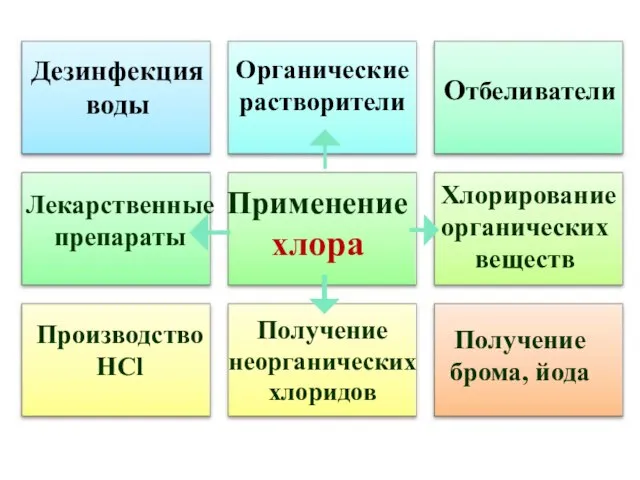
- 19. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
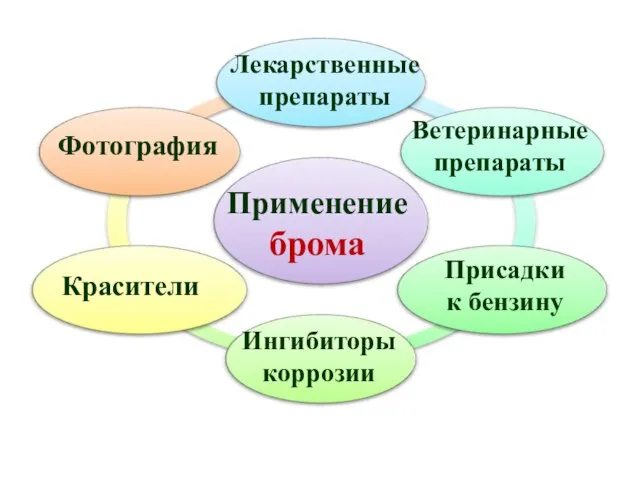
- 20. Применение брома Лекарственные препараты Красители Фотография Ветеринарные препараты Ингибиторы коррозии Присадки к бензину
- 22. Скачать презентацию









 Алюминий. Строение и свойства атома
Алюминий. Строение и свойства атома Развитие ассоциативного мышления на уроках химии
Развитие ассоциативного мышления на уроках химии Презентация на тему Ферменты и гормоны
Презентация на тему Ферменты и гормоны  Классы неорганических соединений
Классы неорганических соединений Решение задач «Биохимия клетки»
Решение задач «Биохимия клетки» Horenie
Horenie Тест 1 задание
Тест 1 задание Сравнение свойств неорганических и органических веществ
Сравнение свойств неорганических и органических веществ Реакции неполного окисления в органике
Реакции неполного окисления в органике Нуклеиновые кислоты
Нуклеиновые кислоты Полиамиды (ПА)
Полиамиды (ПА) Презентация на тему Cкорость химических реакций
Презентация на тему Cкорость химических реакций 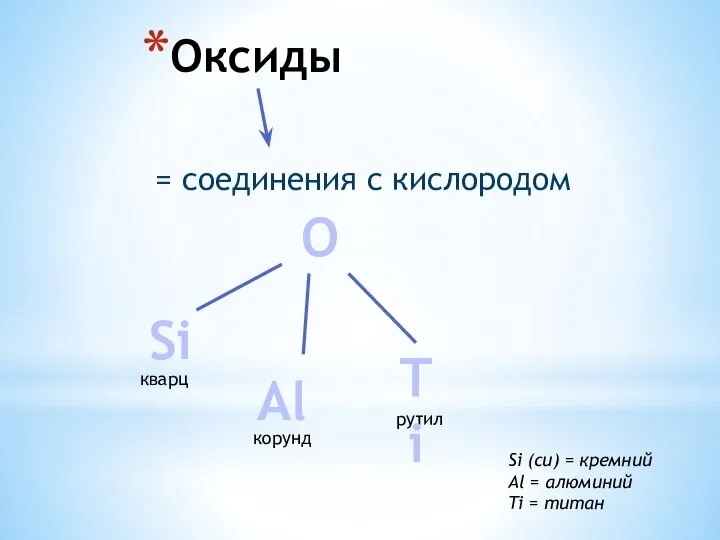 Оксиды. Кварц (SiO2). Корунд (Al2O3)
Оксиды. Кварц (SiO2). Корунд (Al2O3) Предмет органической химии
Предмет органической химии Химическая кинетика
Химическая кинетика Chemia kosmetyczna
Chemia kosmetyczna Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Задания по химии
Задания по химии Общая характеристика неметаллов
Общая характеристика неметаллов Химия на войне
Химия на войне Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Свойства ртути
Свойства ртути Салқындатқыш агенттер
Салқындатқыш агенттер Презентация по Химии "Соединения алюминия"
Презентация по Химии "Соединения алюминия"  Простые и сложные вещества
Простые и сложные вещества Презентация на тему Лекарства дома
Презентация на тему Лекарства дома 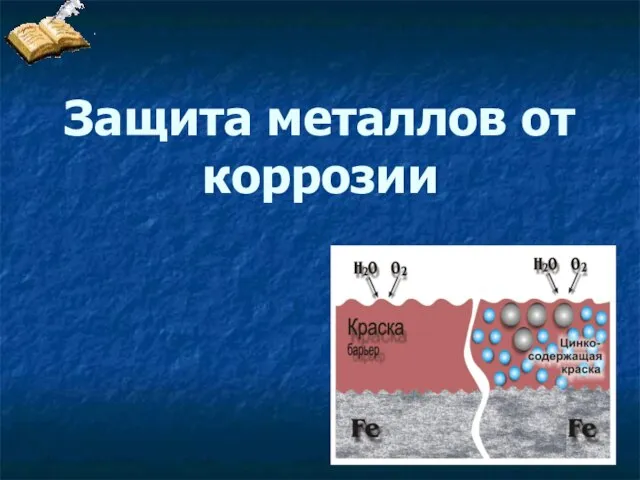 Защита металлов от коррозии
Защита металлов от коррозии Подбор условий определения примесей вБИС-[3(3,5-ДИ-ТРЕТ-БУТИЛ-4
Подбор условий определения примесей вБИС-[3(3,5-ДИ-ТРЕТ-БУТИЛ-4