Содержание
- 13. GЖ, GТ – энергия Гиббсона для жидкого и твердого металла; ΔТ = ТН-ТК, где ТК –
- 14. Диаграммы состояния Диаграмма состояния - графическое изображение фазового состояния сплавов в зависимости от концентрации компонентов и
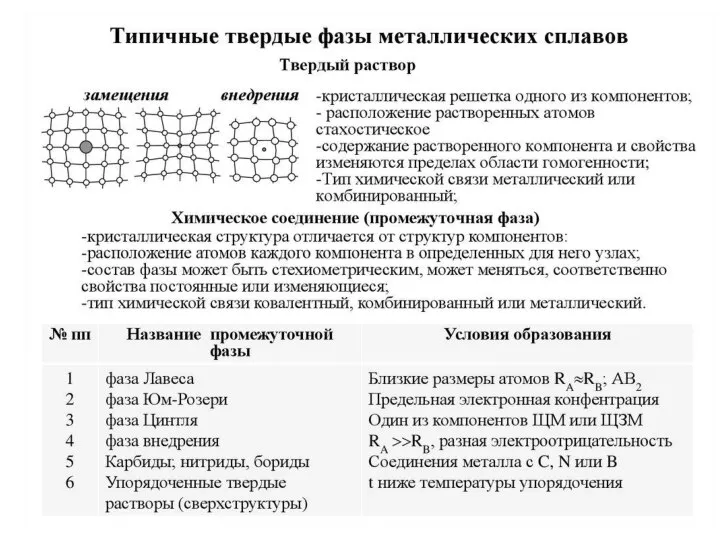
- 17. Фазовый и структурный анализ. Фазовый анализ – описание фаз и указание их на ДС. Задачи ФА:
- 18. С= к-f+1= 2-2+1=1
- 20. Совокупность критических точек начала и конца превращения образуют границу фазовой области. ДС – представляет расположение всех
- 30. Скачать презентацию
Слайд 13GЖ, GТ – энергия Гиббсона для жидкого и твердого металла;
ΔТ = ТН-ТК,
где
GЖ, GТ – энергия Гиббсона для жидкого и твердого металла; ΔТ = ТН-ТК, где
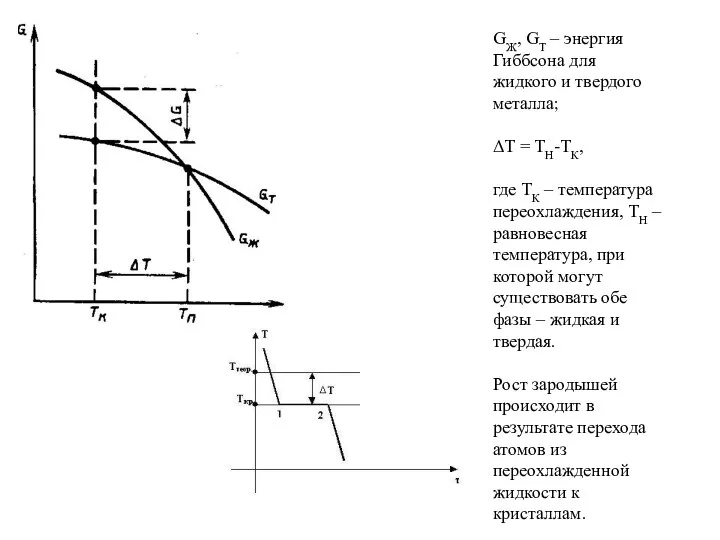
ТК – температура переохлаждения, ТН – равновесная температура, при которой могут существовать обе фазы – жидкая и твердая.
Рост зародышей происходит в результате перехода атомов из переохлажденной жидкости к кристаллам.
Слайд 14Диаграммы состояния
Диаграмма состояния - графическое изображение фазового состояния сплавов в зависимости
Диаграммы состояния
Диаграмма состояния - графическое изображение фазового состояния сплавов в зависимости

от концентрации компонентов и температуры. Это понятие охватывает и равновесные и неравновесные состояния, например, переохлажденные или перегретые. С понятием "диаграмма состояния" не следует отождествлять понятие "диаграмма равновесия фаз", которое отражает равновесное состояние системы, т.е. состояние, когда в системе все превращения полностью завершились. Диаграммами равновесия фаз являются теоретически выведенные диаграммы состояния, т.к. в экспериментальных исследованиях, как правило, не достигается состояния равновесия и изучаются превращения с различным приближением к этому состоянию.
Тем не менее, диаграммы, построенные по экспериментальным данным в условиях медленного изменения температуры, хорошо согласуются с теоретически построенными диаграммами состояния.
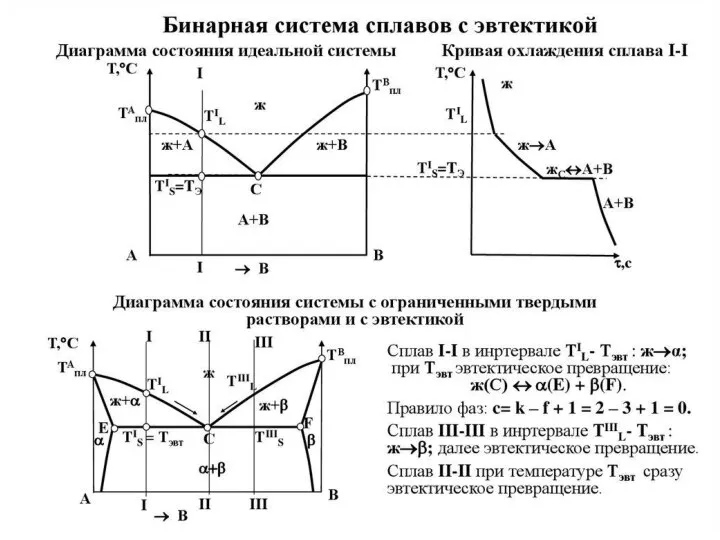
Правило фаз Гиббса - закон термодинамики, который для любой термодинамически равновесной системы устанавливает количественную зависимость между вариантностью, т.е. числом термодинамических степеней свободы системы C, числом компонентов, образующих систему, - K и числом находящихся в равновесии фаз Ф:
C = K + 2 - Ф .
В этом уравнении 2 - число внешних параметров, влияющих на состояние сплава, - температура и давление. Эти два параметра имеют главнейшее значение из внешних факторов. Число степеней свободы, или вариантность системы, указывает число независимых переменных, при изменении которых число фаз, находящихся в равновесии, не изменяется.
Тем не менее, диаграммы, построенные по экспериментальным данным в условиях медленного изменения температуры, хорошо согласуются с теоретически построенными диаграммами состояния.
Правило фаз Гиббса - закон термодинамики, который для любой термодинамически равновесной системы устанавливает количественную зависимость между вариантностью, т.е. числом термодинамических степеней свободы системы C, числом компонентов, образующих систему, - K и числом находящихся в равновесии фаз Ф:
C = K + 2 - Ф .
В этом уравнении 2 - число внешних параметров, влияющих на состояние сплава, - температура и давление. Эти два параметра имеют главнейшее значение из внешних факторов. Число степеней свободы, или вариантность системы, указывает число независимых переменных, при изменении которых число фаз, находящихся в равновесии, не изменяется.
Слайд 17Фазовый и структурный анализ.
Фазовый анализ – описание фаз и указание их на
Фазовый и структурный анализ.
Фазовый анализ – описание фаз и указание их на

ДС.
Задачи ФА:
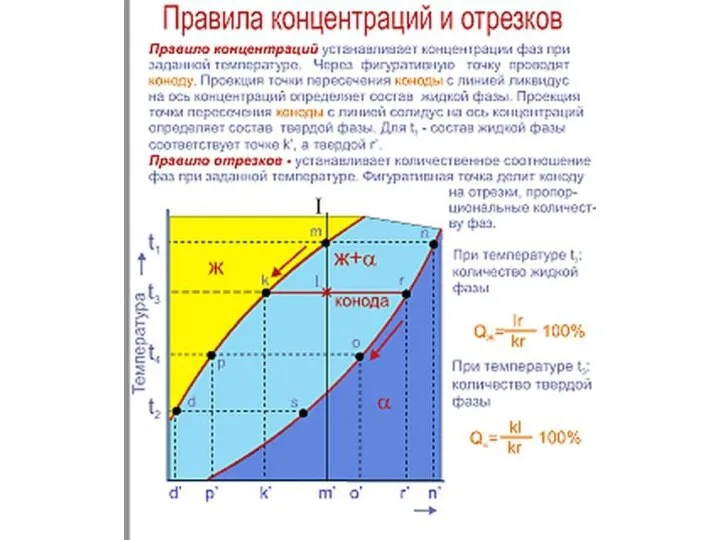
1. Для любой точки ДС определить химический состав и количество каждой фазы.
Хим. Состав определяется по правилу концентраций с помощью КОНОД – горизонталь, проведенная через ближайшие границы фазовых областей. Точки пересечения – хим. Состав равновесных фаз.
Кол-во фаз определяется по правилу обратных отрезков.
Задачи ФА:
1. Для любой точки ДС определить химический состав и количество каждой фазы.
Хим. Состав определяется по правилу концентраций с помощью КОНОД – горизонталь, проведенная через ближайшие границы фазовых областей. Точки пересечения – хим. Состав равновесных фаз.
Кол-во фаз определяется по правилу обратных отрезков.
Для любого сплава определить его конечную структуру, т.е. структуру в затвердевшем
состоянии.
Построение кривых охлаждения.
Анализ протекающих в сплаве превращений.
Слайд 18С= к-f+1= 2-2+1=1
С= к-f+1= 2-2+1=1
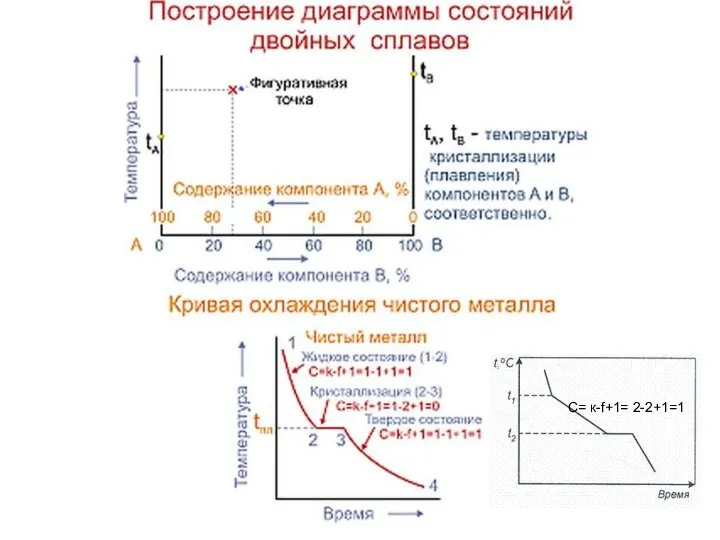
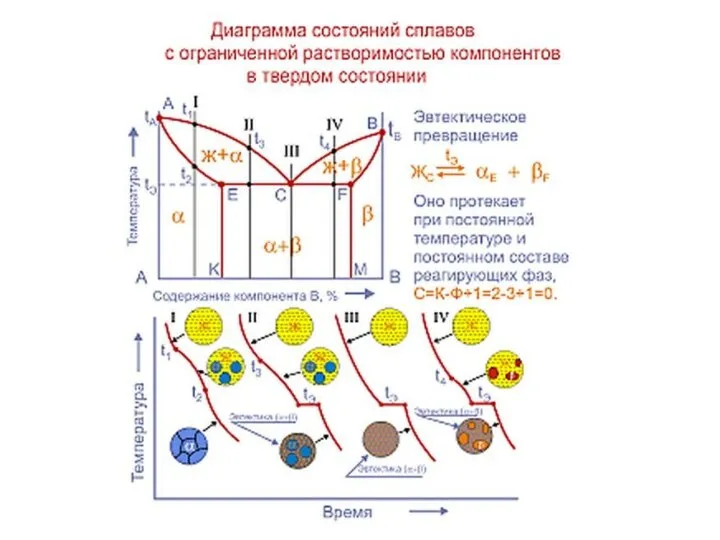
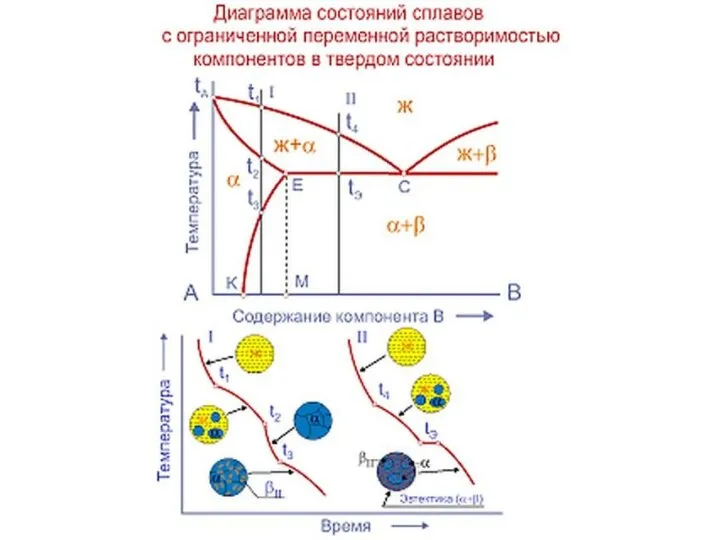
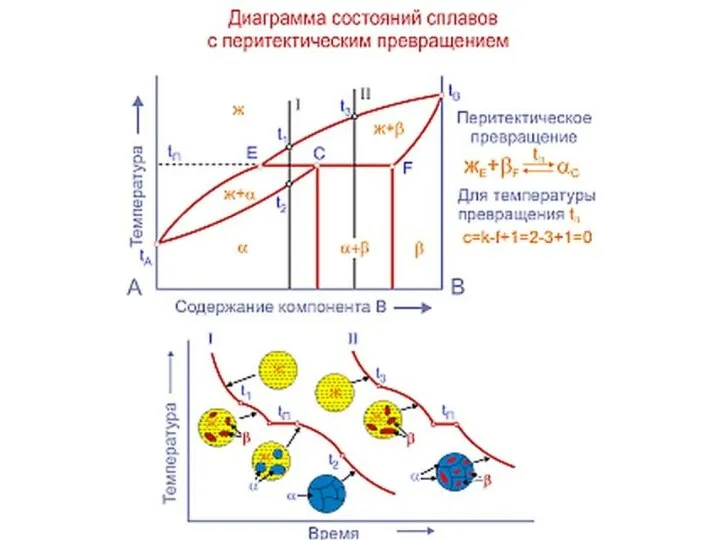
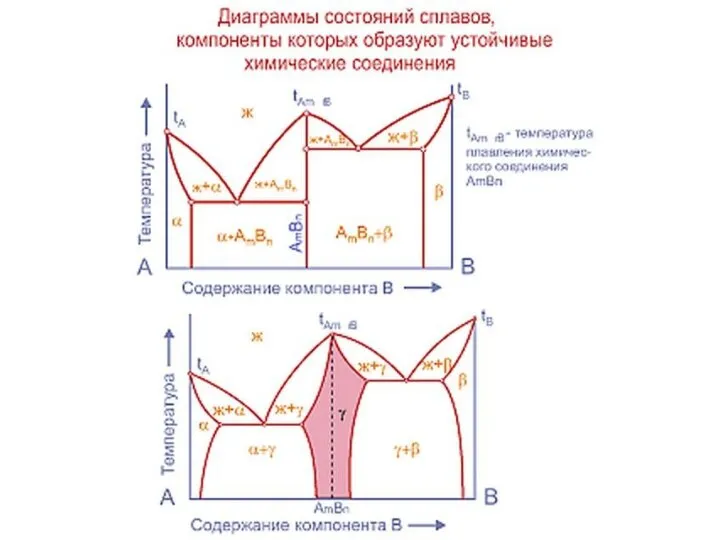
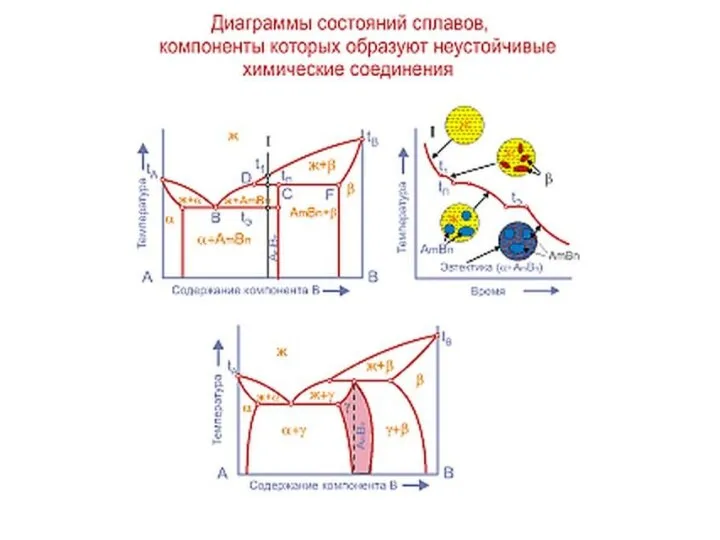
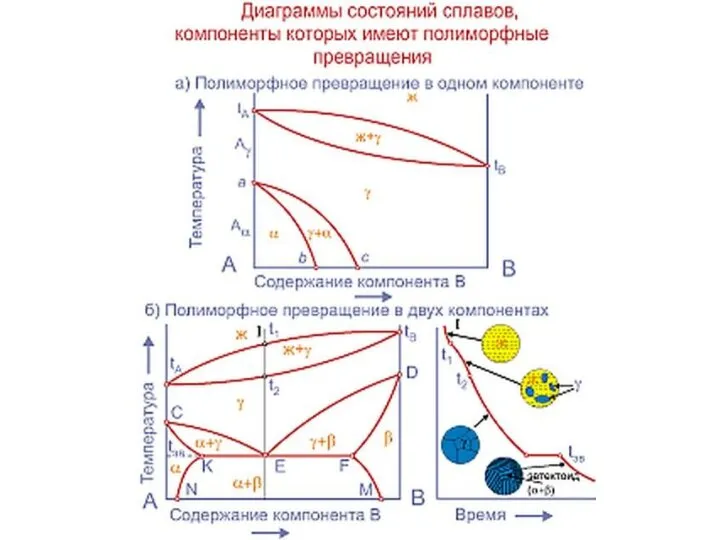
Слайд 20Совокупность критических точек начала и конца превращения образуют границу фазовой области.
ДС –
Совокупность критических точек начала и конца превращения образуют границу фазовой области.
ДС –

представляет расположение всех границ фазовых областей в зависимости от химического состава сплава и его температуры.
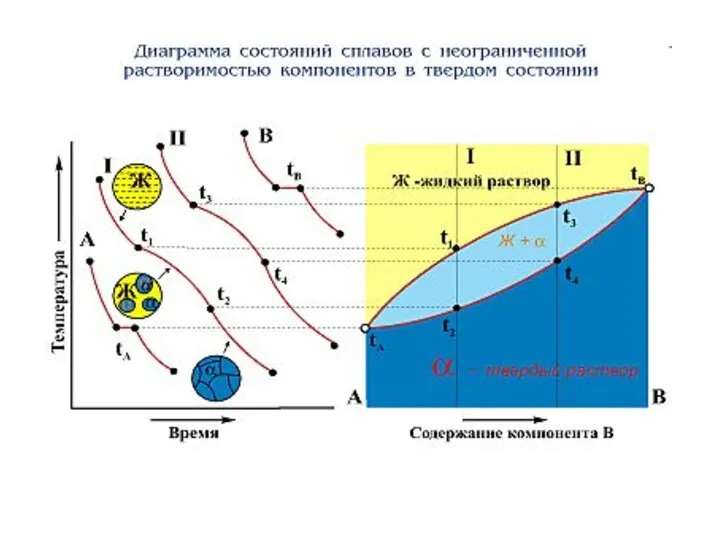
Линия начала кристаллизации – ликвидус
Линия конца кристаллизации - солидус
Линия начала кристаллизации – ликвидус
Линия конца кристаллизации - солидус







 Температура точки росы газа
Температура точки росы газа Изучение основных породообразующих минералов горных пород. Лабораторная работа №1
Изучение основных породообразующих минералов горных пород. Лабораторная работа №1 Аммиак. Свойства (9 класс)
Аммиак. Свойства (9 класс) Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить
Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить Природные кислоты и щелочи. Индикаторы
Природные кислоты и щелочи. Индикаторы Окислительно-восстановительные реакции. Классификация ОВР
Окислительно-восстановительные реакции. Классификация ОВР хімія
хімія Предельные одноатомные спирты
Предельные одноатомные спирты Основания: номенклатура, классификация, применение, физические свойства
Основания: номенклатура, классификация, применение, физические свойства Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Гидролиз солей
Гидролиз солей Химические свойства оксидов
Химические свойства оксидов Металлы и их соединения
Металлы и их соединения Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс)
Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс) Periodická tabuľka prvkov PTP
Periodická tabuľka prvkov PTP Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Кинетика гомогенных реакций
Кинетика гомогенных реакций Известняк. Разновидности известняка. Области применения
Известняк. Разновидности известняка. Области применения Полимеризация бутилена и пропилена
Полимеризация бутилена и пропилена Формирование полимерной структуры при отверждении олигомеров. Каучуки и резины
Формирование полимерной структуры при отверждении олигомеров. Каучуки и резины Минералы и горные породы
Минералы и горные породы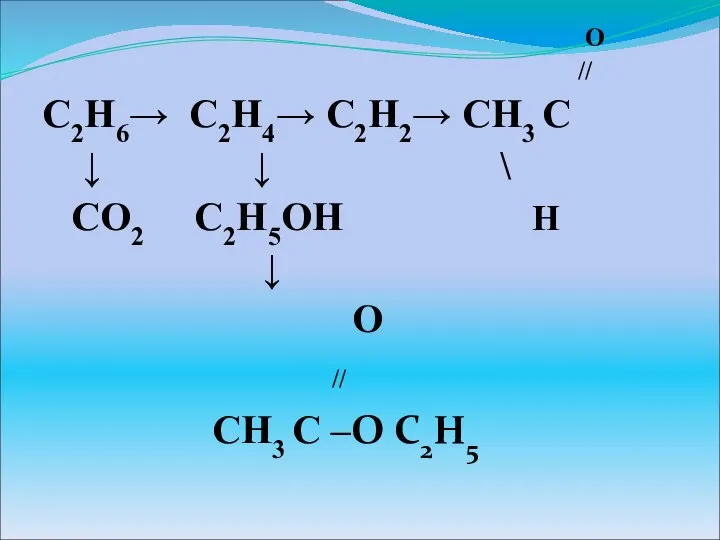 Органические соединения
Органические соединения Типы химических реакций
Типы химических реакций Коррозия металлов и сплавов
Коррозия металлов и сплавов Липиды. Состав липидов
Липиды. Состав липидов Микропластик в окружающей среде
Микропластик в окружающей среде Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды