Содержание
- 2. Основания – Me +n(OH)-n Это сложные вещества, состоящие из ионов металлов и связанных с ними одного
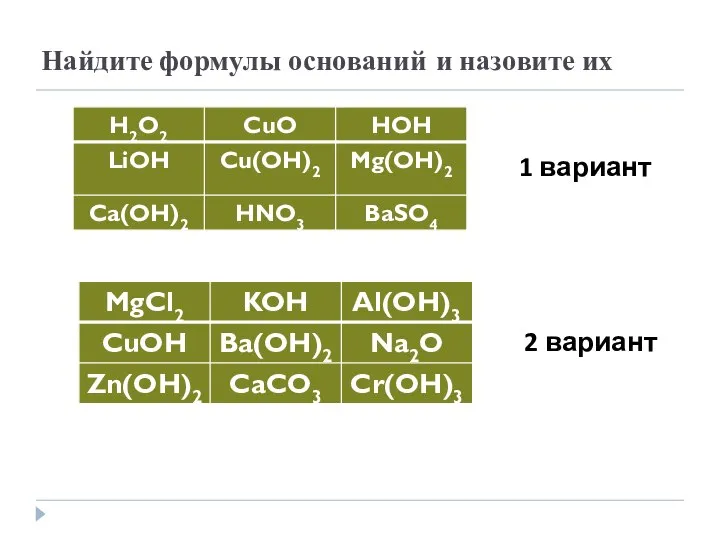
- 3. Найдите формулы оснований и назовите их 1 вариант 2 вариант
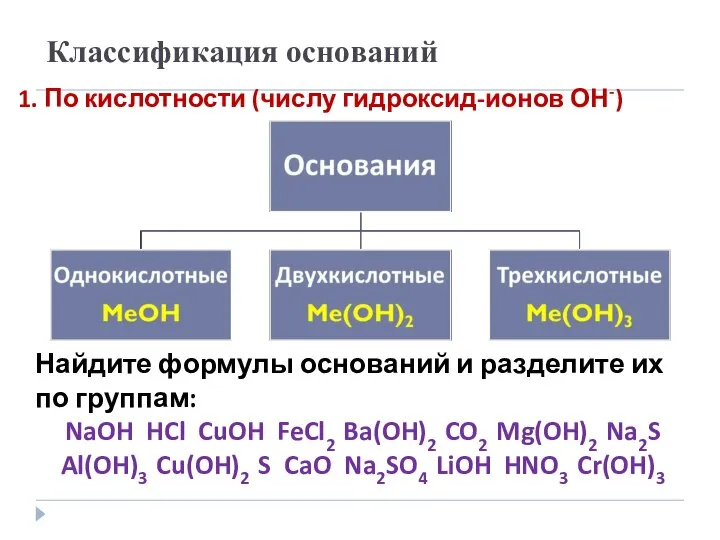
- 4. Классификация оснований 1. По кислотности (числу гидроксид-ионов ОН-) Найдите формулы оснований и разделите их по группам:
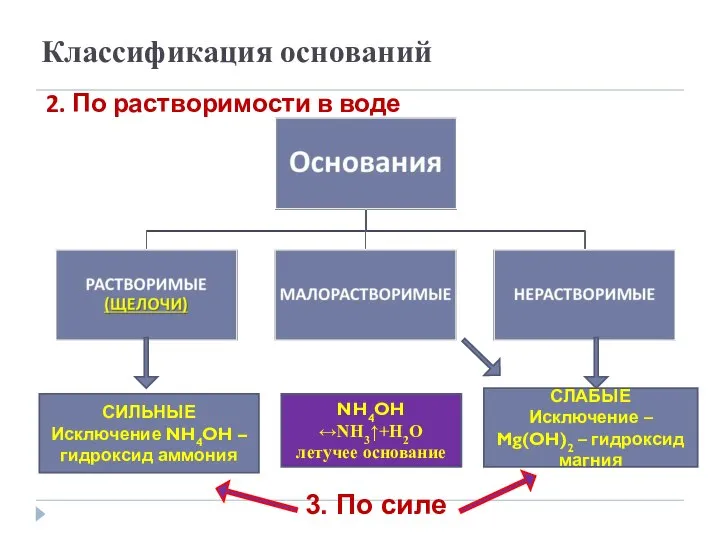
- 5. Классификация оснований 2. По растворимости в воде СЛАБЫЕ Исключение – Mg(OH)2 – гидроксид магния СИЛЬНЫЕ Исключение
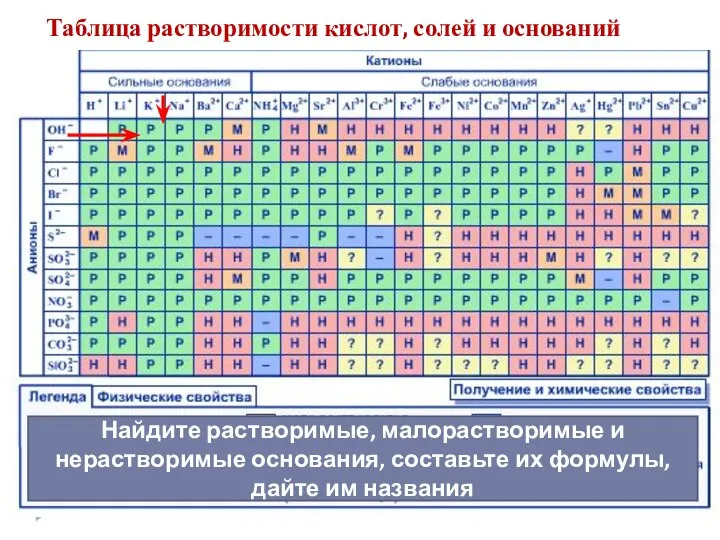
- 6. Таблица растворимости кислот, солей и оснований Найдите растворимые, малорастворимые и нерастворимые основания, составьте их формулы, дайте
- 7. Качественные реакции Реакции, с помощью которых распознают определенные вещества Как можно определить основания? Щелочи – определяют
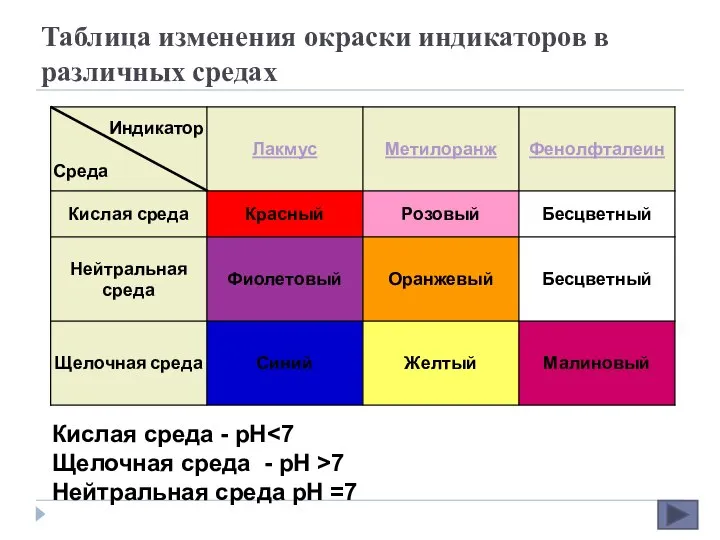
- 8. Таблица изменения окраски индикаторов в различных средах Кислая среда - рН Щелочная среда - рН >7
- 9. Лакмус Красящее вещество природного происхождения, один из первых и наиболее широко известных кислотно-основных индикаторов В кислых
- 10. Мнемоническое правило Для того, чтобы запомнить цвет лакмуса в различных средах, существует стихотворение: Индикатор лакмус —
- 11. Метиловый оранжевый является органическим синтетическим красителем из группы азокрасителей в кислой среде красный, в щелочной —
- 12. Мнемоническое правило Для запоминания цвета индикатора метилового оранжевого в щелочах и кислотах служит стихотворение: От щелочи
- 13. Фенолфталеин Трифенилметановый краситель, кислотно-основный индикатор, изменяющий окраску от бесцветной (при pHТрифенилметановый краситель, кислотно-основный индикатор, изменяющий окраску
- 14. Мнемонические правила Для запоминания цвета фенолфталеина в щелочной среде (в случае его применения в качестве индикатора)
- 15. Качественное определение веществ Известковая вода – качественный реагент на углекислый газ Гидрокси́д ка́льция ( Ca(OH)2 ,
- 16. Известковая вода Прозрачный раствор гидроксида кальция. Она используется для обнаружения углекислого газа. При взаимодействии с ним
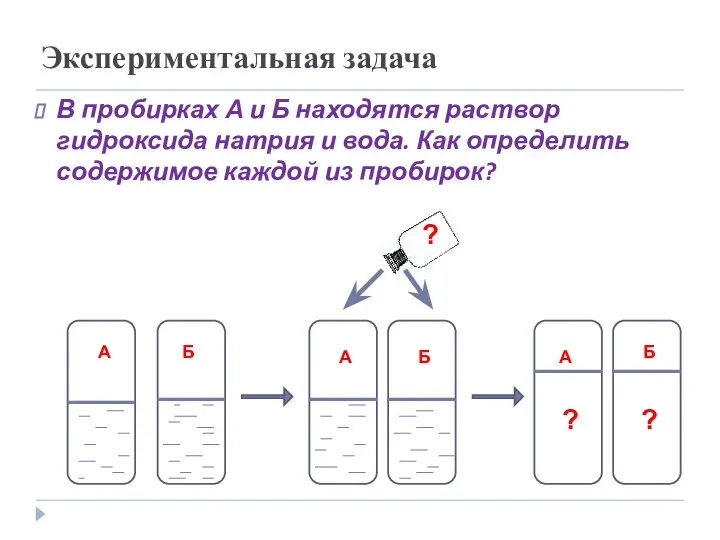
- 17. Экспериментальная задача В пробирках А и Б находятся раствор гидроксида натрия и вода. Как определить содержимое
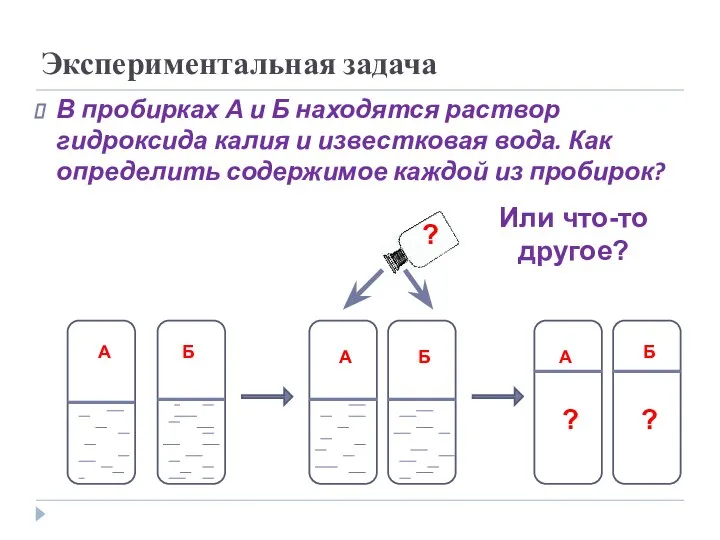
- 18. Экспериментальная задача В пробирках А и Б находятся раствор гидроксида калия и известковая вода. Как определить
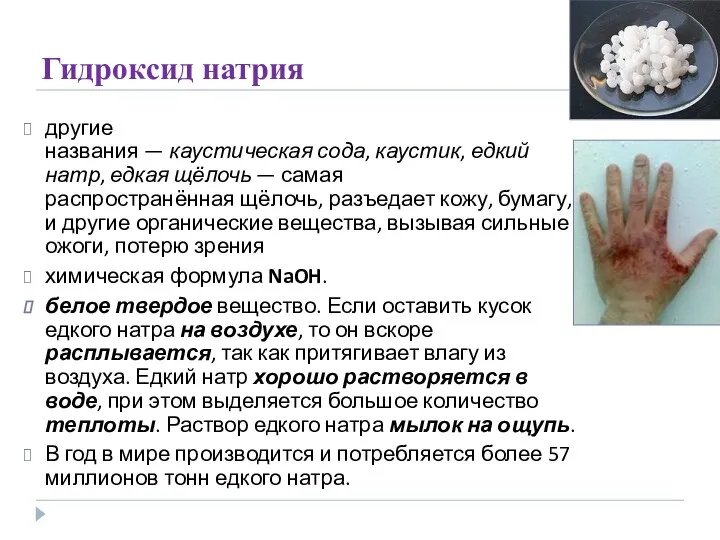
- 19. Гидроксид натрия другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь — самая распространённая щёлочь,
- 20. Историческая справка о NaOH До XVII века щёлочью (фр. alkali) называли также карбонаты натрия и калия.
- 21. Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд: в целлюлозно-бумажной промышленности для делигнификации
- 22. Гидроксид калия «калиевый щёлок» — KOH. Тривиальные названия: едкое кали, каустический поташ. Бесцветные, очень гигроскопичные кристаллы,
- 23. Применение гидроксида калия В пищевой промышленности зарегистрирован в качестве пищевой добавки E525. для получения метана, поглощения
- 24. Техника безопасности при работе с NaOH и KOH При контакте слизистых поверхностей с едкой щёлочью необходимо
- 25. Составить формулы оксидов, соответствующих гидроксидам Например: Гидроксид калия – К+1ОН – оксид калия К+12О Гидроксид натрия
- 26. РЕШИТЕ ЗАДАЧИ Вычислите количество вещества, которое составляют 342 г гидроксида бария. Вычислите количество вещества, которое составляют
- 28. Скачать презентацию

















 Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа
Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа Химия вокруг нас
Химия вокруг нас Виды автомобильного топлива
Виды автомобильного топлива Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl
Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl Витамины и их роль в жизни людей
Витамины и их роль в жизни людей Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 Многоядерные Арены
Многоядерные Арены Химические методы количественного анализа веществ
Химические методы количественного анализа веществ Презентация на тему Выдающиеся русские ученые химики
Презентация на тему Выдающиеся русские ученые химики  Применение одноатомных и многоатомных спиртов
Применение одноатомных и многоатомных спиртов Срспальфа-олефинсульфанаттар
Срспальфа-олефинсульфанаттар 14257fc50bc406ef33f49ad14aa3f48b
14257fc50bc406ef33f49ad14aa3f48b Мило. Вищі карбонові кислоти
Мило. Вищі карбонові кислоти Углеводороды. Урок-игра
Углеводороды. Урок-игра Ароматические углеводороды
Ароматические углеводороды Основные понятия химии
Основные понятия химии Аллотропия Аллотропные видоизменения (модификации)
Аллотропия Аллотропные видоизменения (модификации) Презентация на тему Соединения серы
Презентация на тему Соединения серы  Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2) Классификация ненасыщенных углеводородов
Классификация ненасыщенных углеводородов Природные кристаллы
Природные кристаллы Строение атома
Строение атома Дизельное топливо
Дизельное топливо Этиленгликоль
Этиленгликоль Свойства растворов и их взаимодействие с газовой фазой
Свойства растворов и их взаимодействие с газовой фазой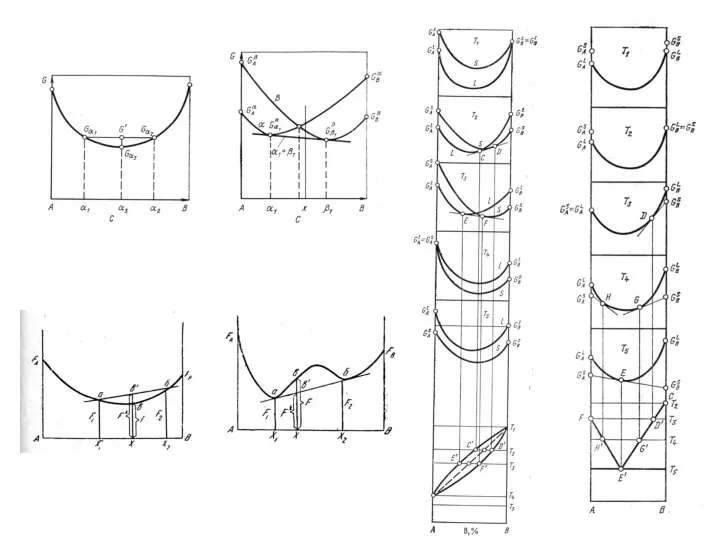 Кинетика кристаллизации сплавов
Кинетика кристаллизации сплавов Металлы и их соединения
Металлы и их соединения Химические свойства алканов. Алканы
Химические свойства алканов. Алканы