Содержание
- 2. Алкены (этиленовые углеводороды) это углеводороды, содержащие в молекуле одну двойную связь. CnH2n общая формула С2Н4 –
- 3. Физические свойства По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях C2–C4 – газы,
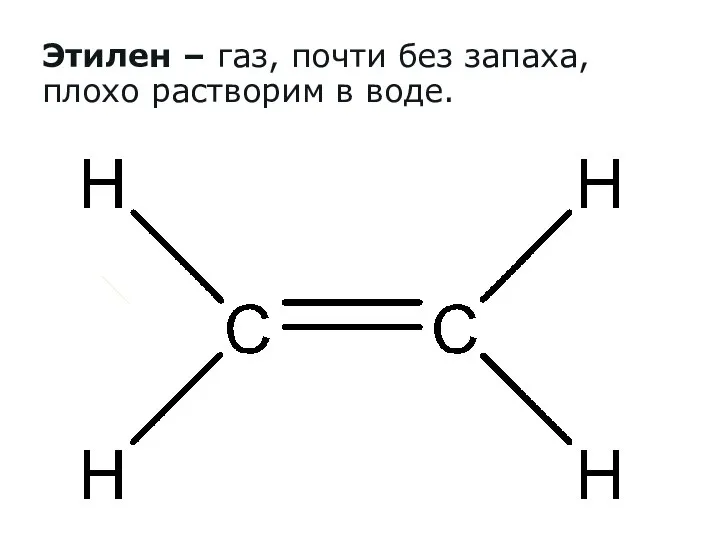
- 4. Этилен – газ, почти без запаха, плохо растворим в воде.
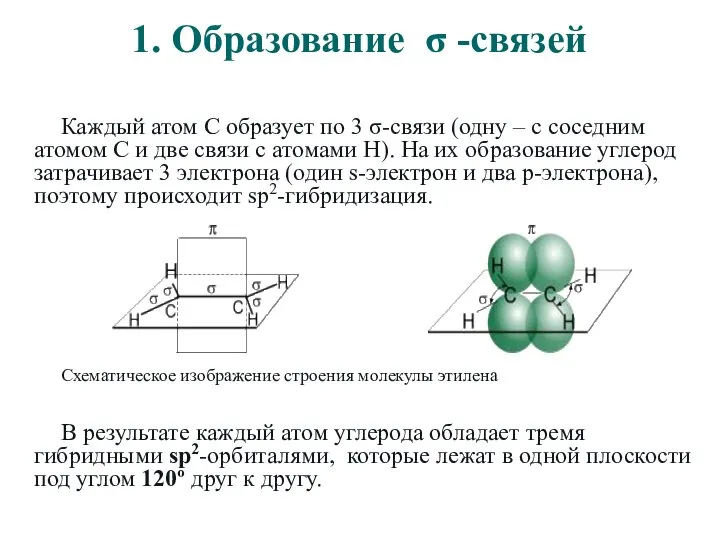
- 5. 1. Образование σ -связей Каждый атом С образует по 3 σ-связи (одну – с соседним атомом
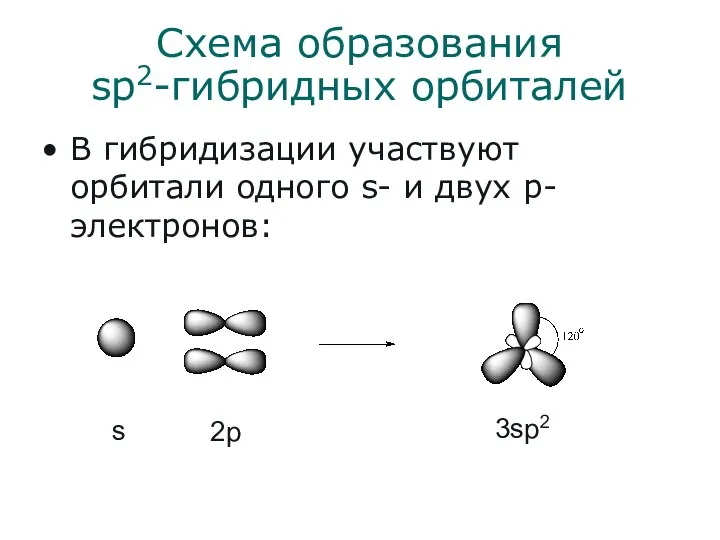
- 6. Схема образования sp2-гибридных орбиталей В гибридизации участвуют орбитали одного s- и двух p-электронов: s 2p 3sp2
- 7. 2. Образование π-связи У каждого атома С есть ещё по одному p-облаку, которые в гибридизации не
- 8. Итак: Простая (ординарная) связь – это всегда σ-связь. В кратных (двойных или тройных) связях – одна
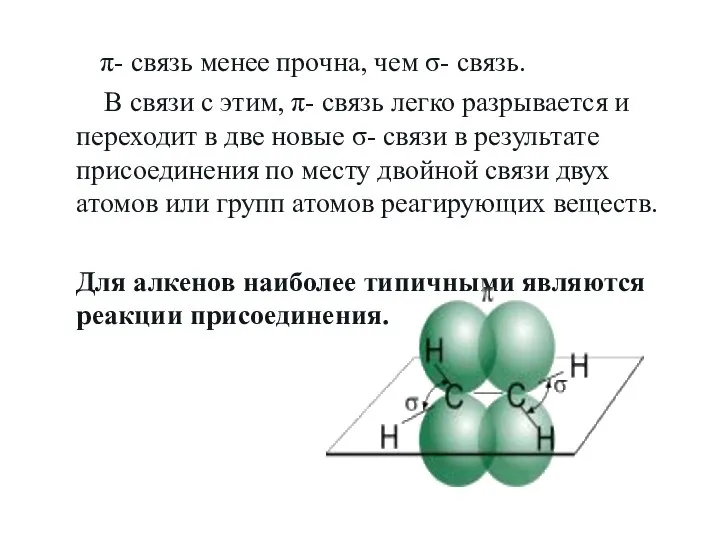
- 9. π- связь менее прочна, чем σ- связь. В связи с этим, π- связь легко разрывается и
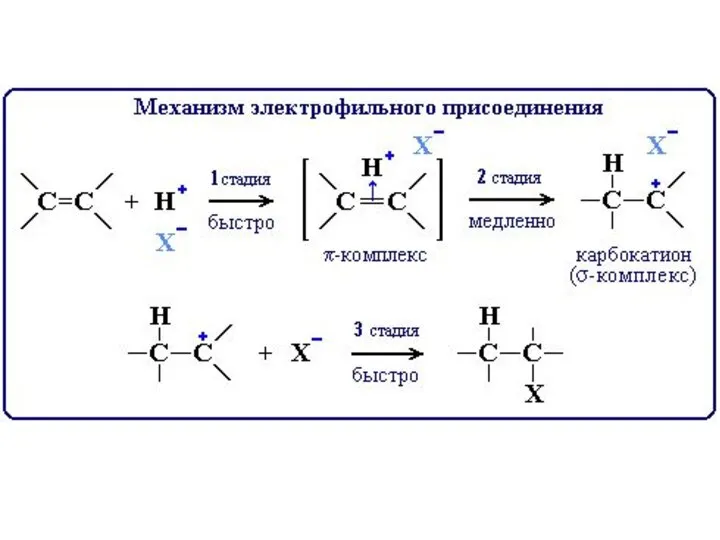
- 10. Реакции присоединения, окисления и полимеризации алкенов идут за счет разрыва двойной связи ( π-связи). Электрофильное присоединение
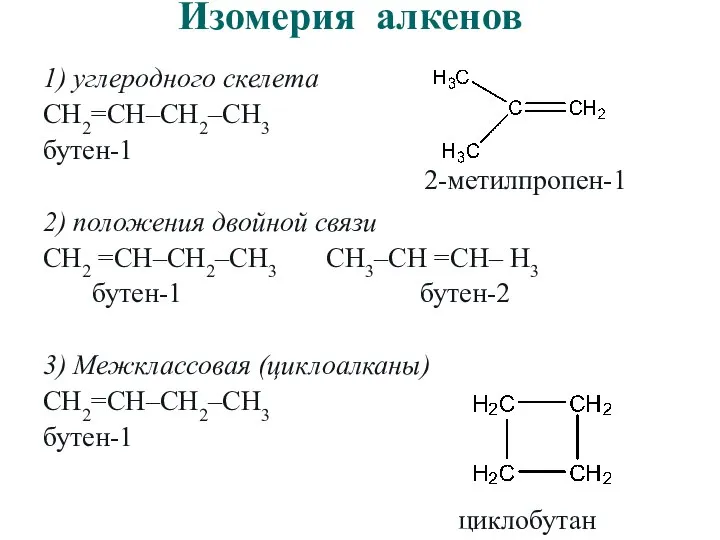
- 11. Изомерия алкенов 1) углеродного скелета CH2=CH–CH2–CH3 бутен-1 2) положения двойной связи CH2 =CH–CH2–CH3 CH3–CH =CH– H3
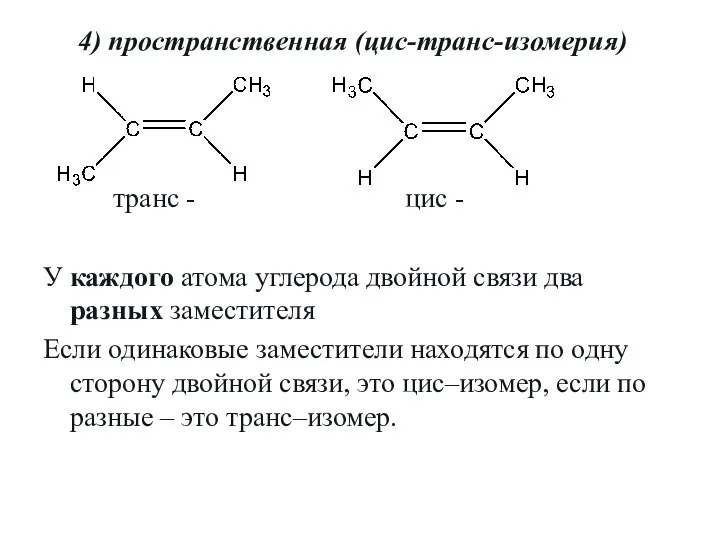
- 12. 4) пространственная (цис-транс-изомерия) транс - цис - У каждого атома углерода двойной связи два разных заместителя
- 13. Номенклатура алкенов Название алкенов по систематической номенклатуре образуют из названий алканов, заменяя суффикс –ан на –ен,
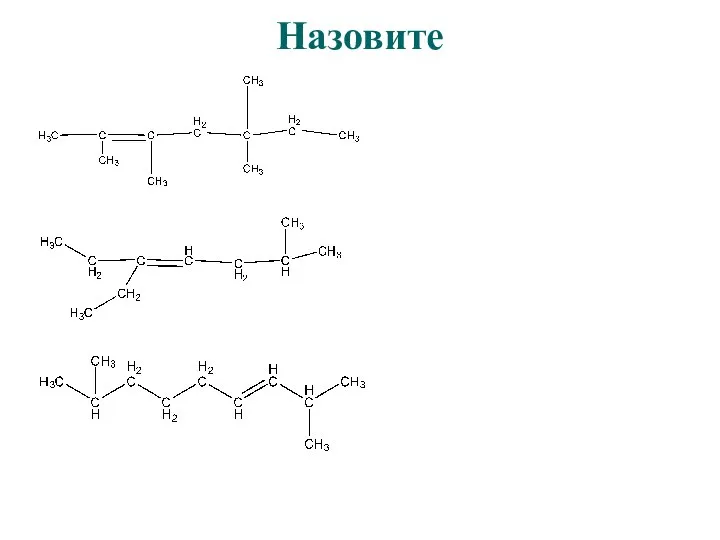
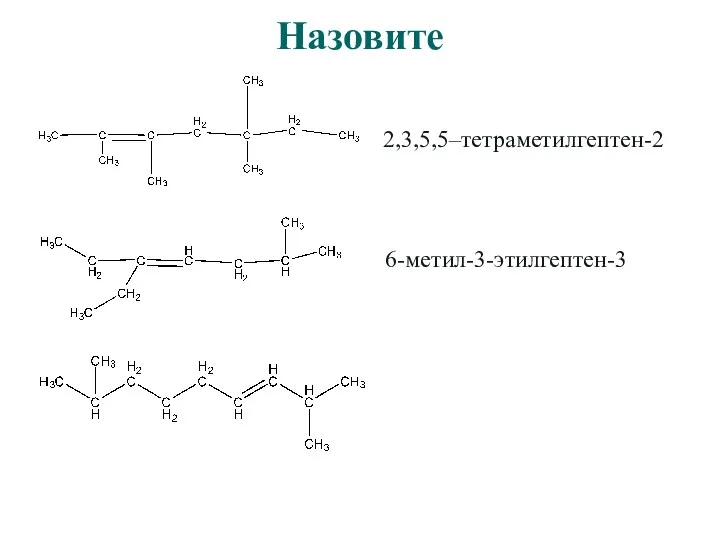
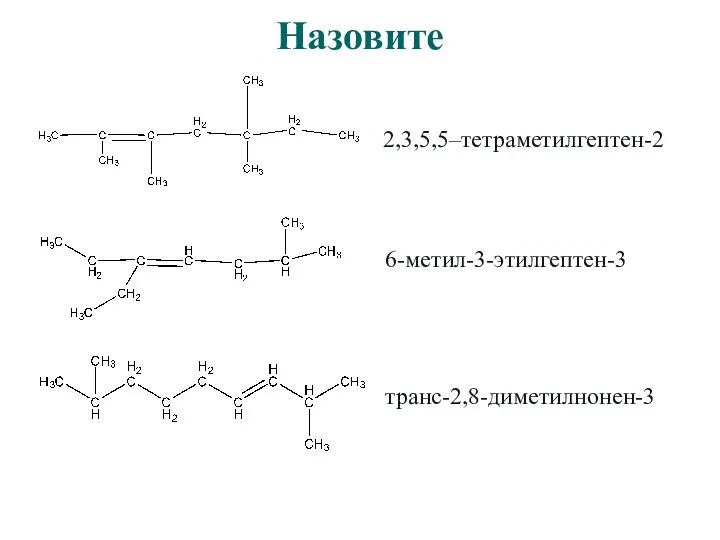
- 14. Назовите
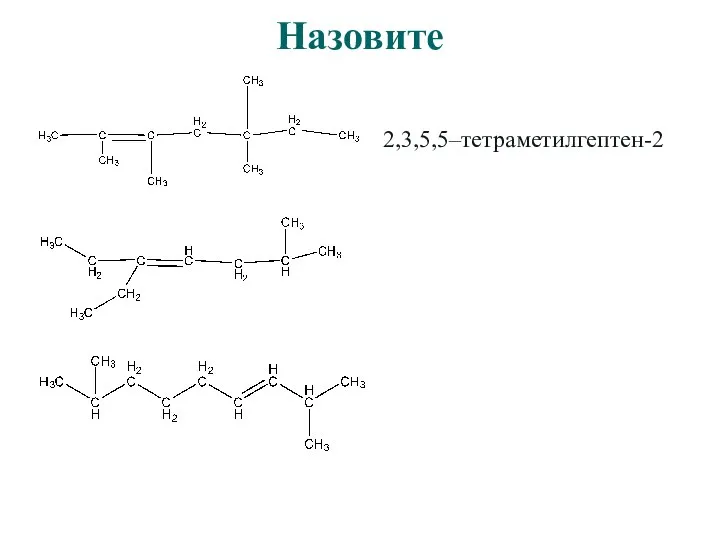
- 15. Назовите 2,3,5,5–тетраметилгептен-2
- 16. Назовите 2,3,5,5–тетраметилгептен-2 6-метил-3-этилгептен-3
- 17. Назовите 2,3,5,5–тетраметилгептен-2 6-метил-3-этилгептен-3 транс-2,8-диметилнонен-3
- 18. Химические свойства алкенов 1) Горение При сжигании на воздухе алкены образуют углекислый газ и воду. C2H4
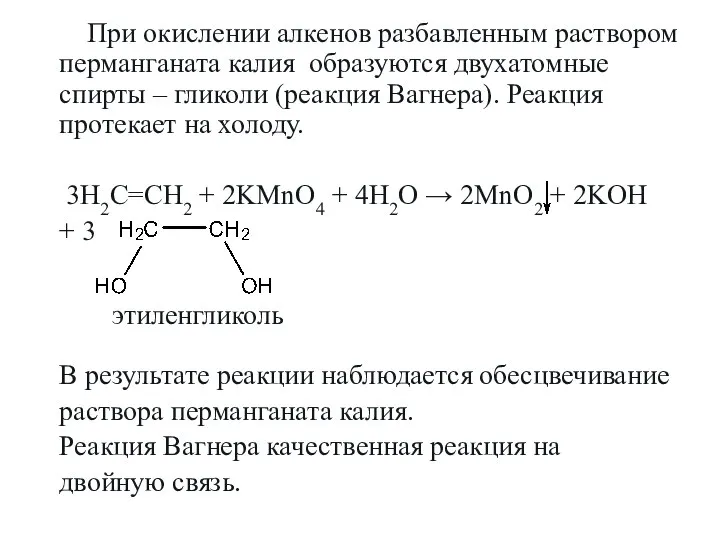
- 19. При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли (реакция Вагнера). Реакция протекает
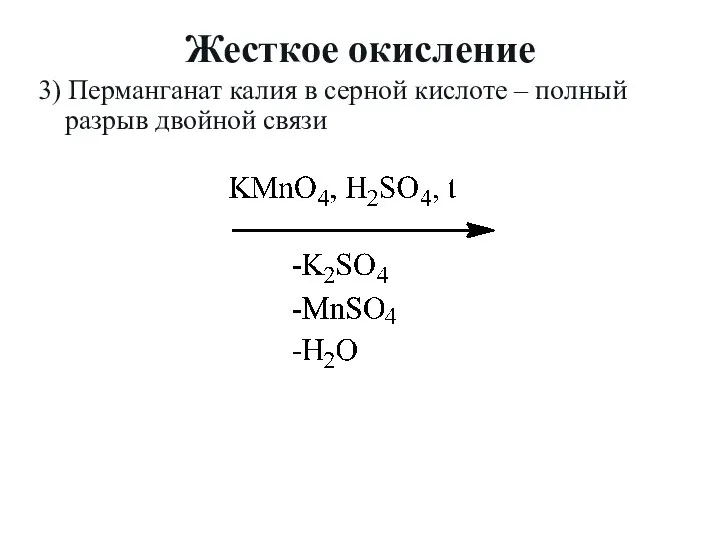
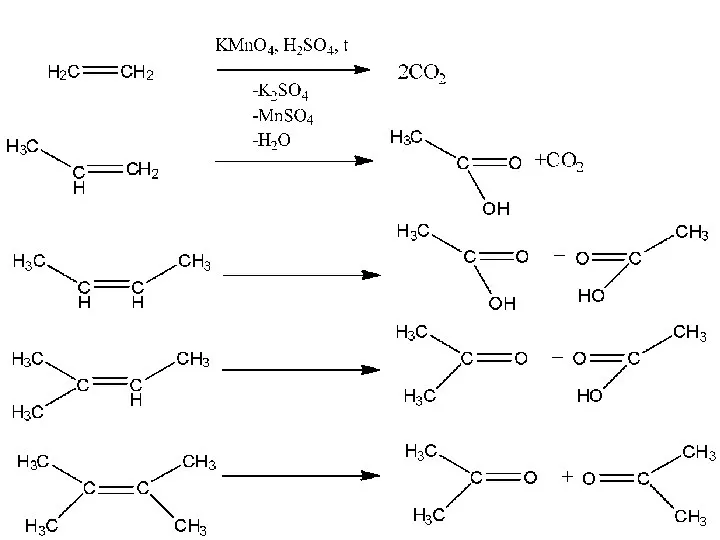
- 20. Жесткое окисление 3) Перманганат калия в серной кислоте – полный разрыв двойной связи
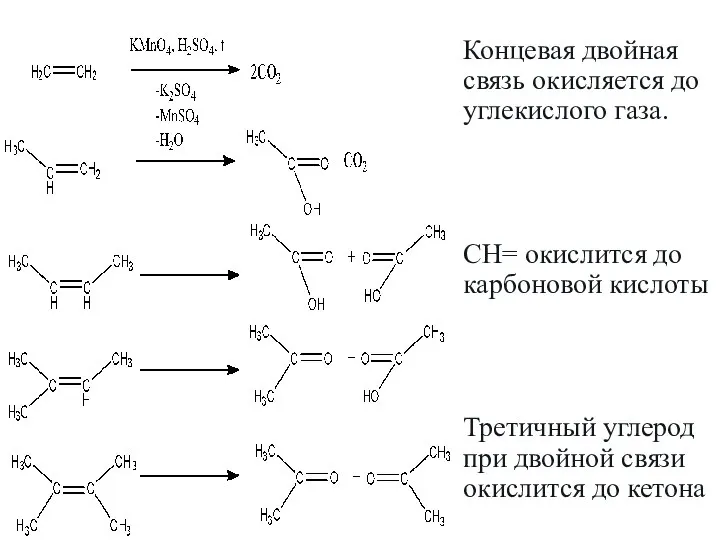
- 22. Концевая двойная связь окисляется до углекислого газа. CH= окислится до карбоновой кислоты Третичный углерод при двойной
- 23. 3) Реакции присоединения. а) Присоединение галогенов - Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к
- 24. б) Гидрирование – присоединение водорода. Алкены легко присоединяют водород в присутствии катализаторов (Pt, Pd, Ni) образуя
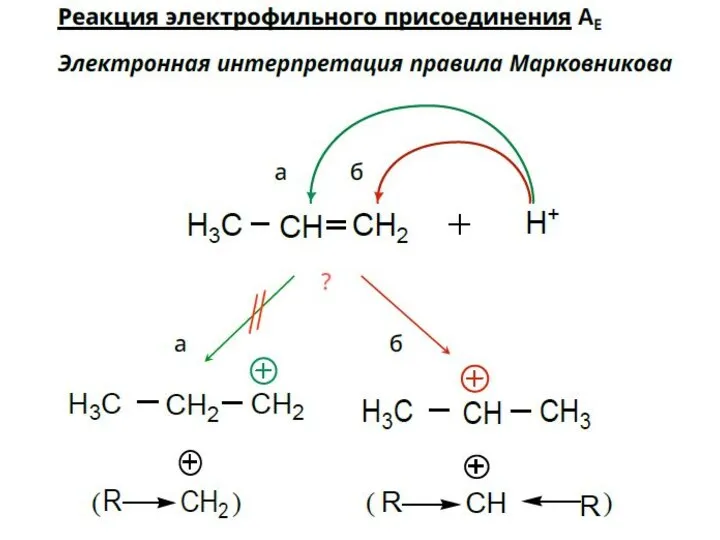
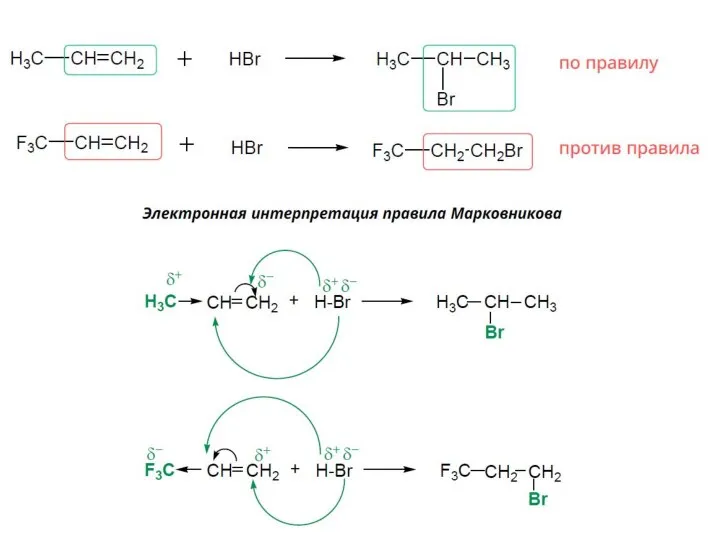
- 25. Присоединение галогеноводородов к несимметричным алкенам происходит в соответствии с правилом Марковникова: При присоединении галогеноводородов или воды
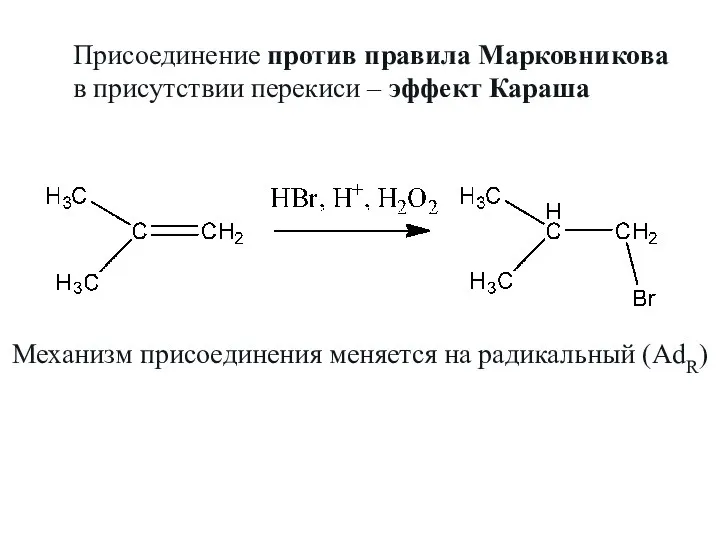
- 29. Присоединение против правила Марковникова в присутствии перекиси – эффект Караша Механизм присоединения меняется на радикальный (AdR)
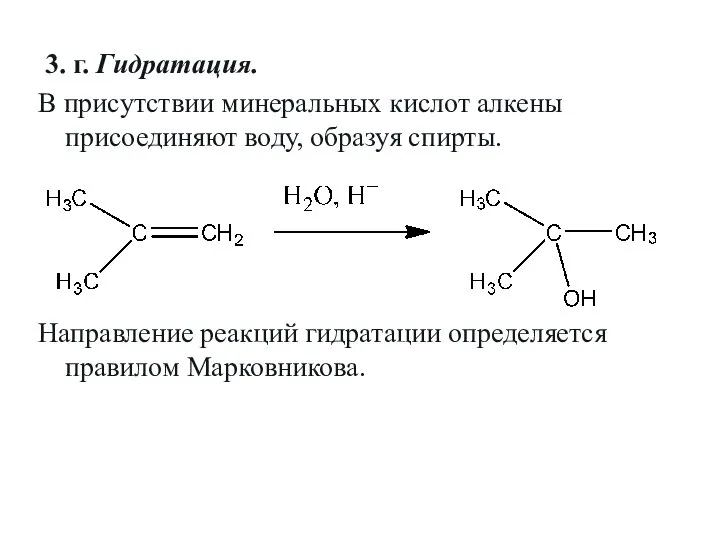
- 30. 3. г. Гидратация. В присутствии минеральных кислот алкены присоединяют воду, образуя спирты. Направление реакций гидратации определяется
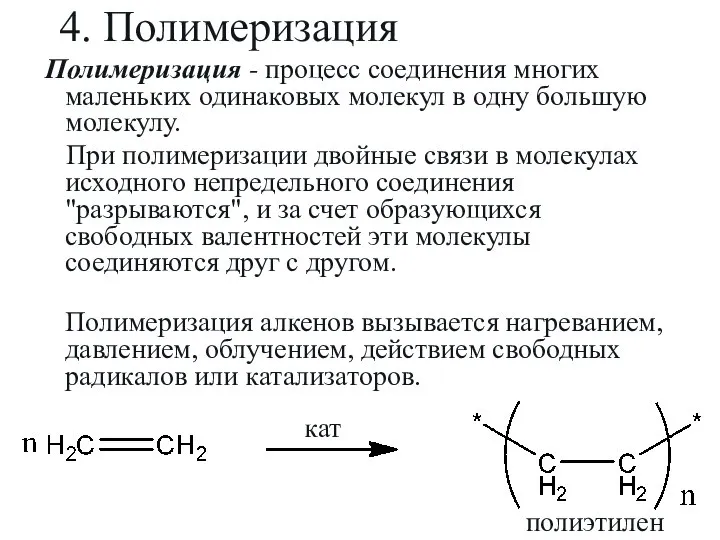
- 31. 4. Полимеризация Полимеризация - процесс соединения многих маленьких одинаковых молекул в одну большую молекулу. При полимеризации
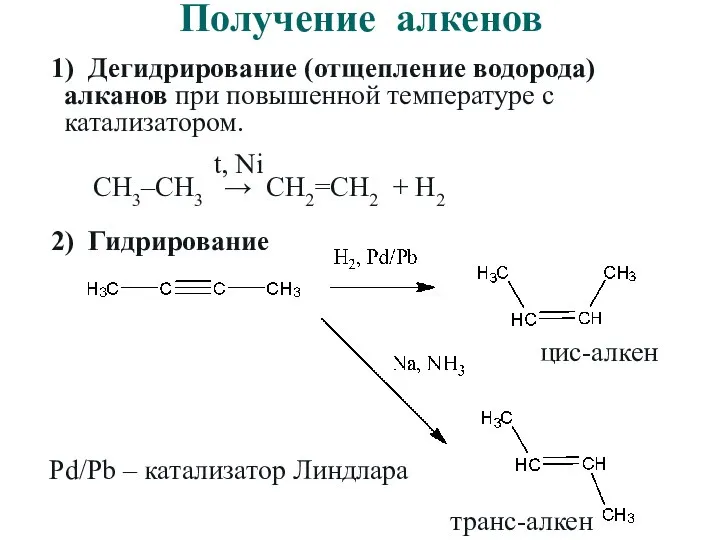
- 32. Получение алкенов 1) Дегидрирование (отщепление водорода) алканов при повышенной температуре с катализатором. СН3–СН3 → СН2=СН2 +
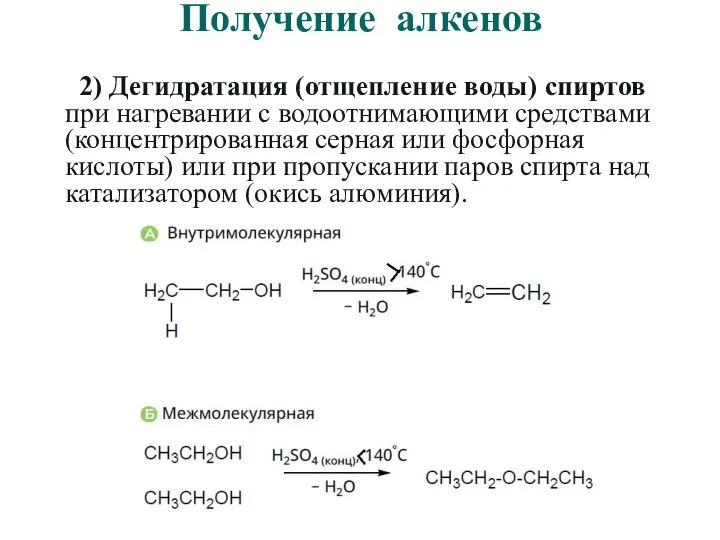
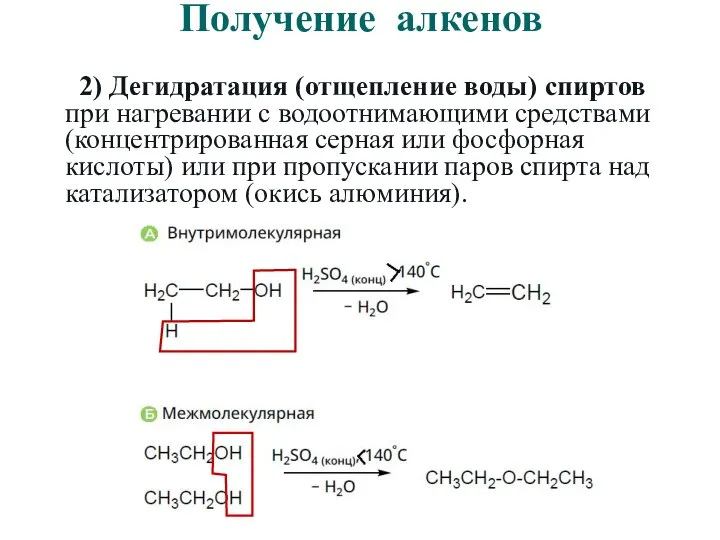
- 33. Получение алкенов 2) Дегидратация (отщепление воды) спиртов при нагревании с водоотнимающими средствами (концентрированная серная или фосфорная
- 34. Получение алкенов 2) Дегидратация (отщепление воды) спиртов при нагревании с водоотнимающими средствами (концентрированная серная или фосфорная
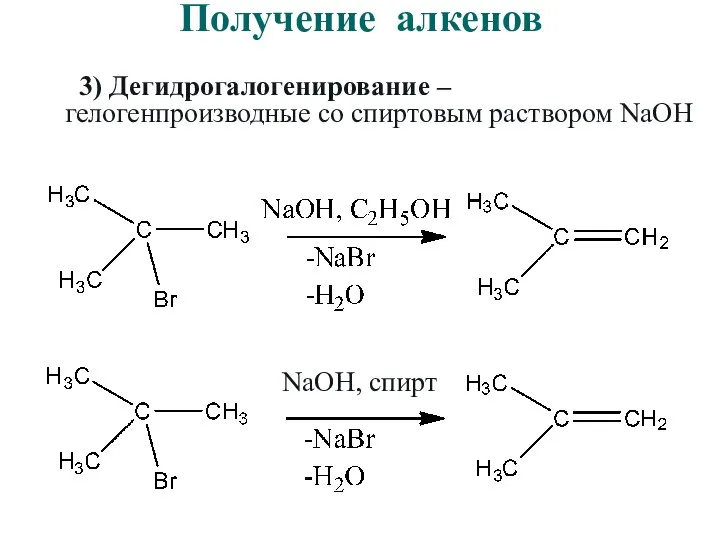
- 35. Получение алкенов 3) Дегидрогалогенирование – гелогенпроизводные со спиртовым раствором NaOH NaOH, спирт
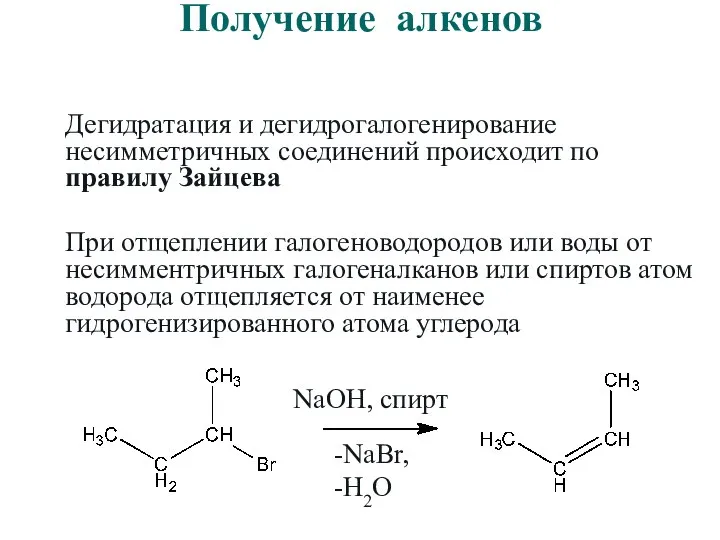
- 36. Получение алкенов Дегидратация и дегидрогалогенирование несимметричных соединений происходит по правилу Зайцева При отщеплении галогеноводородов или воды
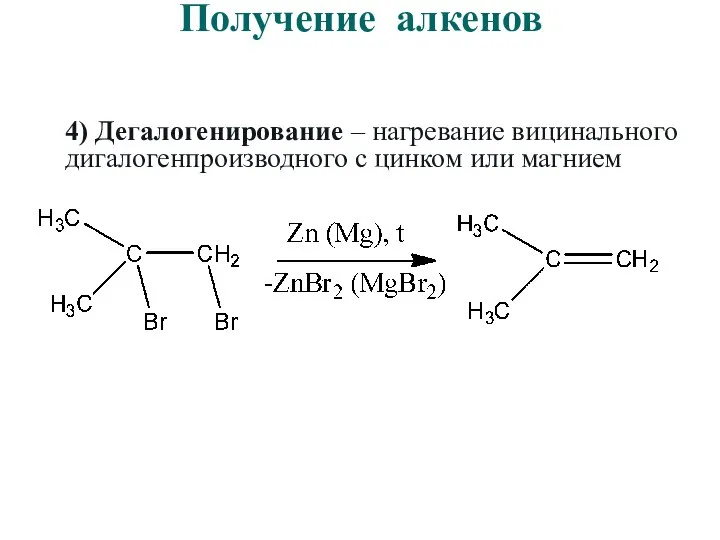
- 37. Получение алкенов 4) Дегалогенирование – нагревание вицинального дигалогенпроизводного с цинком или магнием
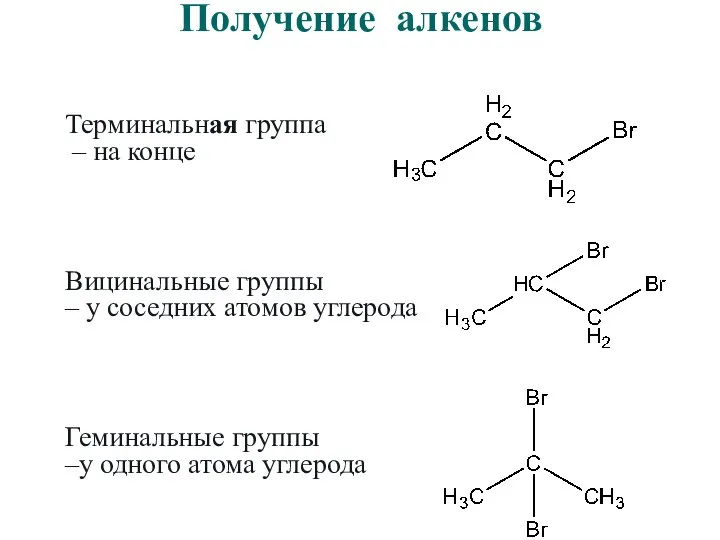
- 38. Получение алкенов Терминальная группа – на конце Вицинальные группы – у соседних атомов углерода Геминальные группы
- 39. Применение алкенов Алкены широко используются в промышленности в качестве исходных веществ в органическом синтезе. Наибольшее значение
- 40. Этилен ускоряет созревание плодов
- 41. В качестве топлива
- 42. Этиленгликоль – для получения антифризов, тормозных жидкостей
- 43. Дихлорэтан – растворитель
- 44. Дихлорэтан – для борьбы с вредителями (окуривание зернохранилищ)
- 45. Хлорэтан, бромэтан – для наркоза при легких операциях
- 46. Этиловый спирт - растворитель, антисептик в медицине, в производстве синтетического каучука…
- 47. Производство полиэтилена
- 48. Изоляция проводов и кабелей
- 49. Трубы
- 50. Тара
- 52. Скачать презентацию




















 Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Амины. Аминокислоты. Белки. (Лекция 8)
Амины. Аминокислоты. Белки. (Лекция 8) Тренинг по решению задач разной степени сложности по теме Углеводороды
Тренинг по решению задач разной степени сложности по теме Углеводороды Кроссворд первоначальные понятия
Кроссворд первоначальные понятия Химическая мастерская
Химическая мастерская Металдар мен қорытпалардың құрылысы және қасиеттері
Металдар мен қорытпалардың құрылысы және қасиеттері Белки. Тест
Белки. Тест Сахароза, крахмал, целлюлоза
Сахароза, крахмал, целлюлоза Газ тәрізді өнімдер бромды сутек
Газ тәрізді өнімдер бромды сутек Кислород
Кислород Сравнительный анализ питьевой бутилированной воды
Сравнительный анализ питьевой бутилированной воды Решение расчетных задач на нахождение химической формулы вещества
Решение расчетных задач на нахождение химической формулы вещества Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6
Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6 Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Химические реакции. Подготовка к контрольной работе №2
Химические реакции. Подготовка к контрольной работе №2 Соединения щелочноземельных металлов
Соединения щелочноземельных металлов Классификация неорганических веществ
Классификация неорганических веществ Стекло. Технология изготовления стекла
Стекло. Технология изготовления стекла Ионные уравнения. Практическая работа
Ионные уравнения. Практическая работа Углеволокно (карбон)
Углеволокно (карбон) Химическая Кинетика
Химическая Кинетика Ar, Mr
Ar, Mr Закон сохранения массы веществ. Признаки химических реакций
Закон сохранения массы веществ. Признаки химических реакций Альдегиды
Альдегиды Самородные элементы. Сера. Лекция 7
Самородные элементы. Сера. Лекция 7 Различные варианты заданий ЕГЭ по теме Электролиз
Различные варианты заданий ЕГЭ по теме Электролиз Термохимическое уравнение реакции полного сгорания ацетилена
Термохимическое уравнение реакции полного сгорания ацетилена Химия в сельском хозяйстве, быту, медицине
Химия в сельском хозяйстве, быту, медицине