Содержание
- 2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ, ПРОТЕКАЮЩИЕ НА ЭЛЕКТРОДАХ ПРИ ПРОПУСКАНИИ ПОСТОЯННОГО ЭЛЕКТРИЧЕСКОГО ТОКА ЧЕРЕЗ РАСТВОРЫ ИЛИ РАСПЛАВЫ ЭЛЕКТРОЛИТОВ, НАЗЫВАЮТ
- 3. ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ Катодные процессы в водных растворах электролитов :катионы или молекулы воды принимают электронов
- 4. Cu2+ + 2e– = Cu0, E0=0,337 В 2H2O + 2e– = H2 + 2OH–, E0=–0,83 В
- 5. 2. Катионы металлов с малой величиной стандартного электродного потенциала (катионы металлов начала ряда напряжений Li+, Na+,
- 6. 3. Катионы металлов со стандартным электродным потенциалом меньшим, чем у ВОДОРОДА, но большим, чем у алюминия
- 7. 4. На катоде легче всего разряжаются катионы того металла, которому отвечает наиболее положительный потенциал. Так, например,
- 8. АНОДНЫЕ ПРОЦЕССЫ На аноде происходит окисление анионов или молекул воды ( частицы отдают электронов - окисляются)
- 9. НА АНОДЕ ОКИСЛЯЮТСЯ АНИОНЫ БЕСКИСЛОРОДНЫХ КИСЛОТ, OH– ИЛИ МОЛЕКУЛЫ ВОДЫ 2Cl– – 2e– = Cl2 2H2O
- 10. ПРАВИЛА ПРОЦЕССОВ ЭЛЕКТРОЛИЗА При электролизе водного раствора соли из активного металла и кислородосодержащей кислоты на катоде
- 11. При электролизе раствора соли из активного металла и бескислородной кислоты на катоде образуется - Н2, на
- 12. ПРАВИЛА ПРОЦЕССОВ ЭЛЕКТРОЛИЗА При электролизе водного раствора соли из малоактивного металла и кислородосодержащей кислоты на катоде
- 13. ПРАВИЛА ПРОЦЕССОВ ЭЛЕКТРОЛИЗА При электролизе катиона аммония NH4+ восстанавливается вода. При электролизе солей органических кислот на
- 14. ПРАВИЛА ПРОЦЕССОВ ЭЛЕКТРОЛИЗА Электролиз раствора щелочи – это электролиз воды. Электролиз раствора кислородосодержащей кислоты – это
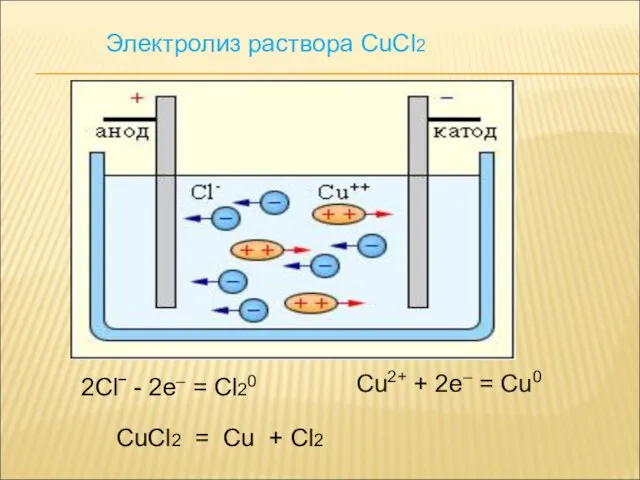
- 16. Электролиз раствора CuCl2 2Clˉ - 2e– = Cl20 Cu2+ + 2e– = Cu0 CuCl2 = Cu
- 18. Скачать презентацию














 Спирты. Непредельные спирты
Спирты. Непредельные спирты Полимерные материалы и изделия
Полимерные материалы и изделия Золото. Физические свойства золота
Золото. Физические свойства золота Презентация на тему Алхимики
Презентация на тему Алхимики  Элементы формообразования (6 класс)
Элементы формообразования (6 класс) Транспорт веществ
Транспорт веществ Молекулярно-массовое распределение
Молекулярно-массовое распределение Основные понятия физической химии
Основные понятия физической химии Изомерия алкенов
Изомерия алкенов Презентация на тему Фолиевая кислота
Презентация на тему Фолиевая кислота  Основания. 8 класс
Основания. 8 класс Хлороводород и соляная кислота
Хлороводород и соляная кислота Наука ковала Победу. 1941-1945
Наука ковала Победу. 1941-1945 Первоначальные химические понятия
Первоначальные химические понятия Строение атома алюминия. Физические и химические свойства алюминия
Строение атома алюминия. Физические и химические свойства алюминия Гидролиз солей
Гидролиз солей Валентные состояния атома углерода
Валентные состояния атома углерода Периодическая система
Периодическая система Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Коррозия металла
Коррозия металла Классы неорганических веществ
Классы неорганических веществ Гідроліз солей
Гідроліз солей Презентация на тему Химия в медицине
Презентация на тему Химия в медицине  Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Химия в жизни общества
Химия в жизни общества Фотодиссоциация кислорода
Фотодиссоциация кислорода Очистка рабочих электродов
Очистка рабочих электродов Оксиды
Оксиды