Содержание
- 2. Сераорганические соединения Классификация: Тиоспирты RSH Тиоэфиры (сульфиды) RSR’ Дисульфиды RS2R’ Полисульфиды RSnR’ Сульфеновые кислоты RSOH Сульфиновые
- 3. Тиоспирты (тиолы) Тиолы можно рассматривать как производные сероводорода, в котором один атом водорода замещен углеводородным остатком.
- 4. Номенклатура Номенклатура тиолов подобна номенклатуре гидроксипроизводных, только вместо суффикса ол- применяется -тиол или вместо префикса гидрокси-
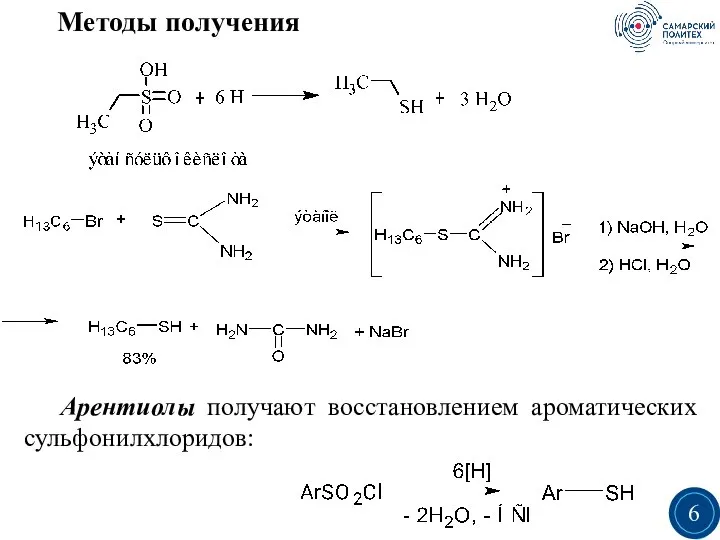
- 5. Методы получения Алкантиолы получают реакциями алкилирования сероводорода и его солей. Реакция протекает по механизму бимолекулярного нуклеофильного
- 6. Методы получения Арентиолы получают восстановлением ароматических сульфонилхлоридов: 3 6
- 7. Физические свойства Тиолы представляют собой соединения с чрезвычайно неприятным запахом, который обнаруживается даже в малых концентрациях.
- 8. Химические свойства Реакции тиолов обусловлены главным образом участием связи S-H и нуклеофильными свойствами атома серы. Тиолы
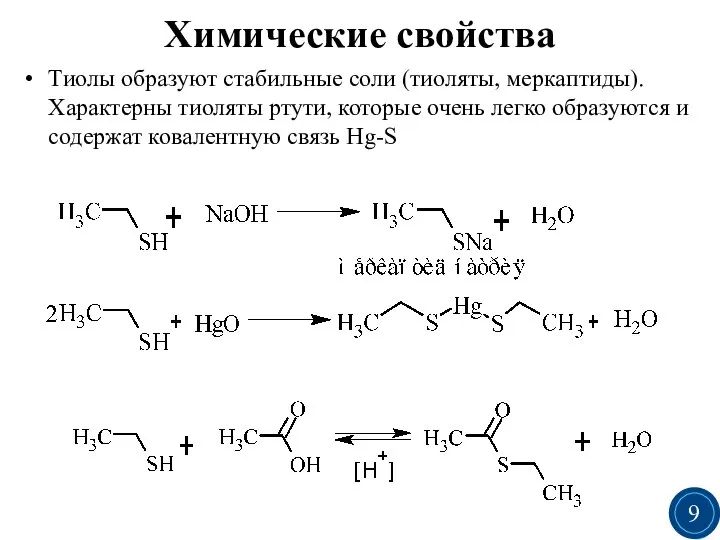
- 9. Химические свойства Тиолы образуют стабильные соли (тиоляты, меркаптиды). Характерны тиоляты ртути, которые очень легко образуются и
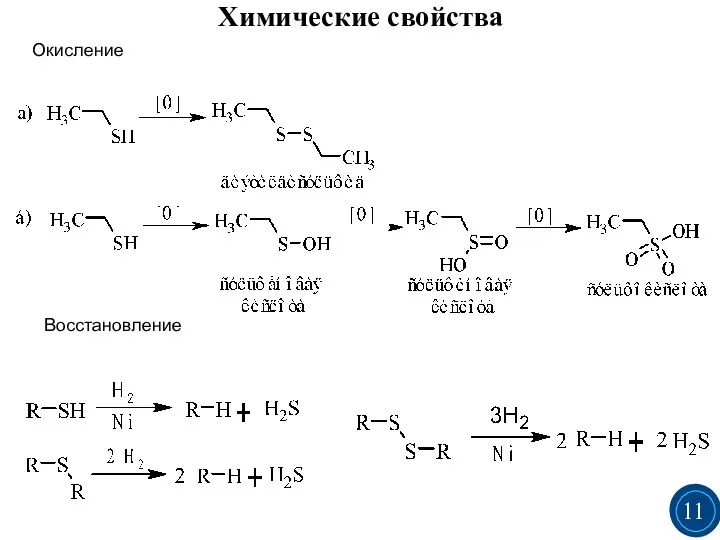
- 10. Тиолы и особенно тиоляты легко окисляются. Первичным продуктом окисления является дисульфид, который может подвергаться дальнейшим превращениям:
- 11. Химические свойства Окисление Восстановление 3 3 11
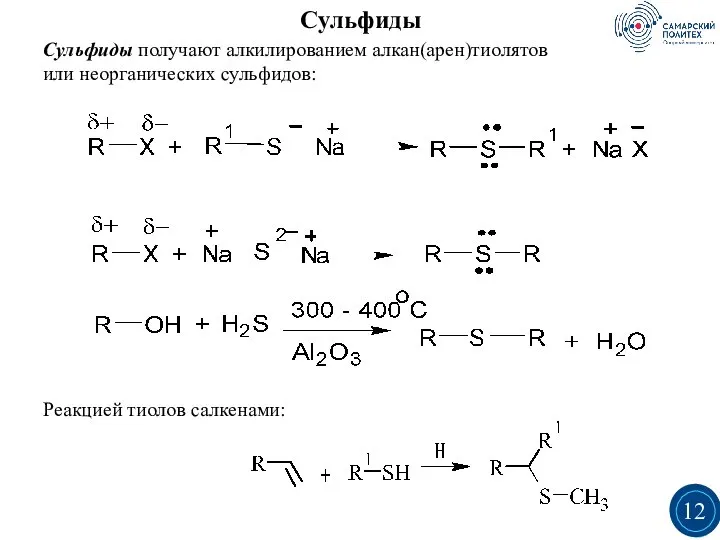
- 12. Сульфиды получают алкилированием алкан(арен)тиолятов или неорганических сульфидов: Реакцией тиолов салкенами: Сульфиды 3 3 12
- 13. Сульфиды Для получения диарилсульфидов используют реакцию галогенидов серы с аренами в присутствии кислот Льюиса: Дисульфиды получают
- 14. Сульфиды и дисульфиды являются веществами с неприятным запахом. Их температуры кипения выше, чем у аналогичных простых
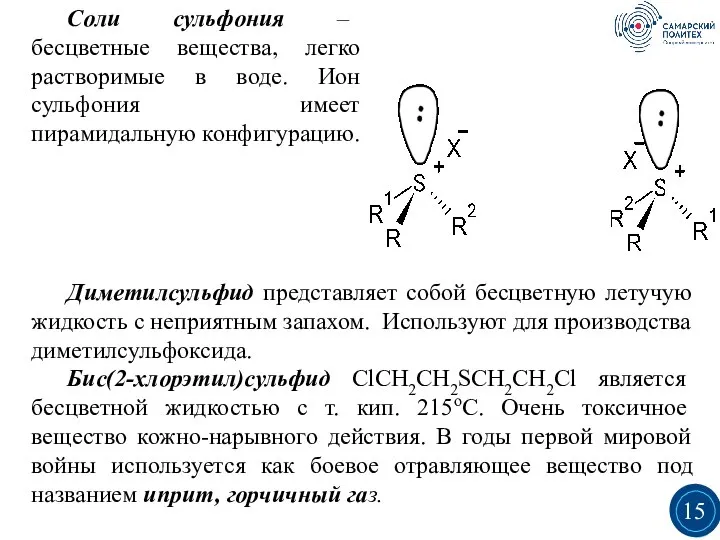
- 15. Соли сульфония – бесцветные вещества, легко растворимые в воде. Ион сульфония имеет пирамидальную конфигурацию. Диметилсульфид представляет
- 16. Химические свойства Химические свойства сульфидов и дисульфидов определяются большой подвижностью электронной системы атома серы. Они легко
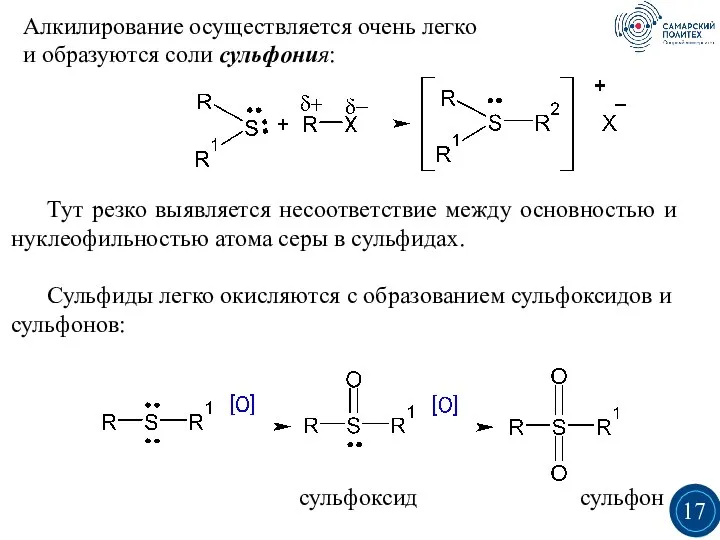
- 17. Алкилирование осуществляется очень легко и образуются соли сульфония: Тут резко выявляется несоответствие между основностью и нуклеофильностью
- 18. Сульфоксиды Обладают свойствами слабых оснований и очень слабых СН-кислот. Диметилсульфоксид (CH3)2S=O – бесцветная жидкость. Кипит при
- 19. Сульфоны. Химические свойства. Сульфоны образуются в качестве побочных продуктов и реакциях сульфирования. При повышении температуры реакции
- 21. Скачать презентацию












 Основания. Простые и сложные ионы
Основания. Простые и сложные ионы Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли
Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли Классы неорганических соединений
Классы неорганических соединений Общая химическая технология. Составление материального баланса технологического процесса. Практическое занятие 6
Общая химическая технология. Составление материального баланса технологического процесса. Практическое занятие 6 Термохимические уравнения
Термохимические уравнения Cиликат кальция
Cиликат кальция Металлы. Общая характеристика
Металлы. Общая характеристика Нуклеин қышқылдары
Нуклеин қышқылдары Презентация на тему Сахароза
Презентация на тему Сахароза  Многогранность- моё второе имя. Задача
Многогранность- моё второе имя. Задача Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4
Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4 Урок изучения и первичного усвоения знаний с элементами исследования на тему: «Окислительно-восстановительные свойства соединен
Урок изучения и первичного усвоения знаний с элементами исследования на тему: «Окислительно-восстановительные свойства соединен Свойства кальция и магния. Жёсткость воды. Лекция №7
Свойства кальция и магния. Жёсткость воды. Лекция №7 Физический этап развития периодического закона
Физический этап развития периодического закона Гармонизации терминологии аналитической химии с использованием электронной системы на основе MS WSS (Windows SharePoint Services) Широкова В.И.,
Гармонизации терминологии аналитической химии с использованием электронной системы на основе MS WSS (Windows SharePoint Services) Широкова В.И.,  Презентация на тему Чистые вещества и смеси
Презентация на тему Чистые вещества и смеси  Путешествие в мир кислот
Путешествие в мир кислот Окислительновосстановительные реакции. 9 класс
Окислительновосстановительные реакции. 9 класс День химии
День химии Степень окисления
Степень окисления Презентации 1 строение атома
Презентации 1 строение атома Бинарные соединения – оксиды и летучие водородные соединения. 8 класс
Бинарные соединения – оксиды и летучие водородные соединения. 8 класс Диффузия золота и свинца
Диффузия золота и свинца Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Toshkent davlat texnika instituti
Toshkent davlat texnika instituti Топливо и расчеты его горения
Топливо и расчеты его горения Лекарственные средства – производные пиримидин 2,4,6-триона
Лекарственные средства – производные пиримидин 2,4,6-триона Поликонденсация. Гомополиконденсациия
Поликонденсация. Гомополиконденсациия