Содержание
- 2. Теория Бренстеда-Лоури (1923) Й.-Н. Бренстед Т. М. Лоури Кислота - это нейтральная молекула (или ион), способная
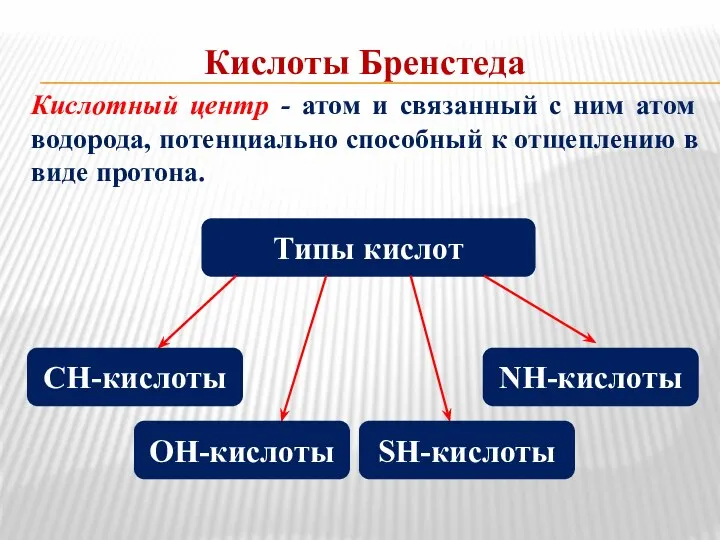
- 3. Кислоты Бренстеда Кислотный центр - атом и связанный с ним атом водорода, потенциально способный к отщеплению
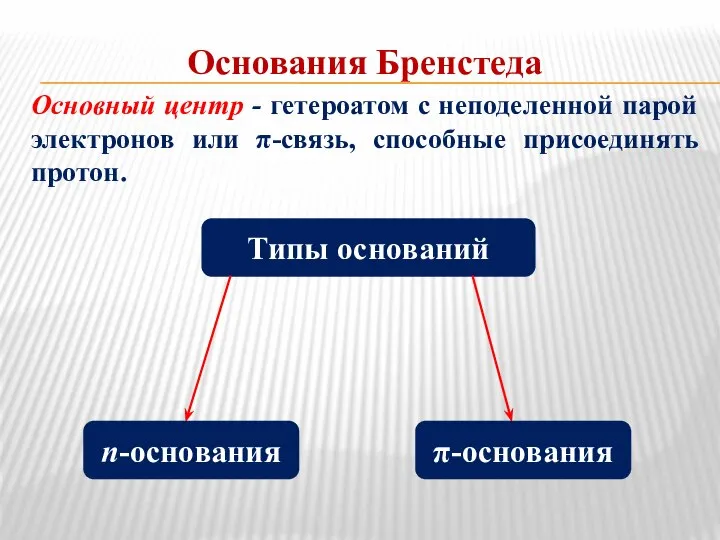
- 4. Основания Бренстеда Основный центр - гетероатом с неподеленной парой электронов или π-связь, способные присоединять протон. Типы
- 5. Факторы, влияющие на кислотность Сила кислоты определяется стабильностью сопряженного основания (аниона) – чем стабильнее анион, тем
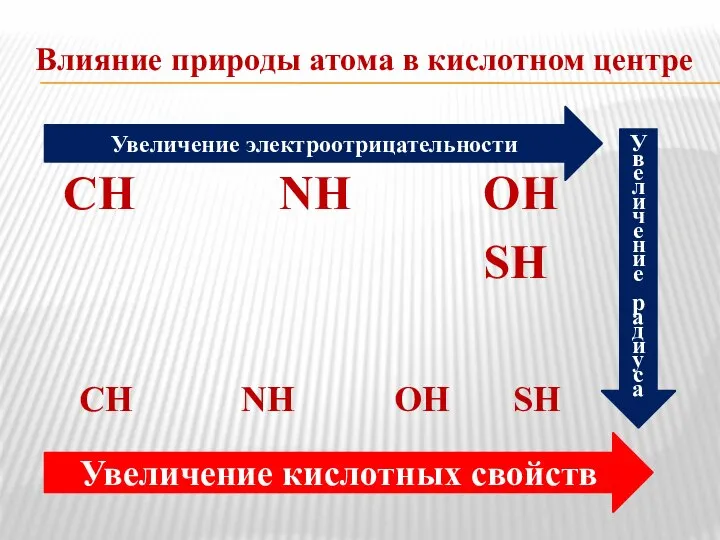
- 6. Влияние природы атома в кислотном центре СН NH ОН SH СН NH ОН SH Увеличение электроотрицательности
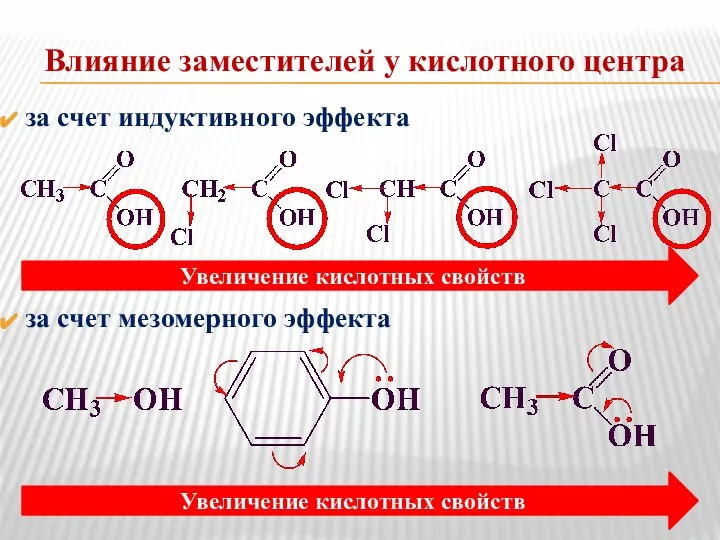
- 7. Влияние заместителей у кислотного центра за счет индуктивного эффекта за счет мезомерного эффекта Увеличение кислотных свойств
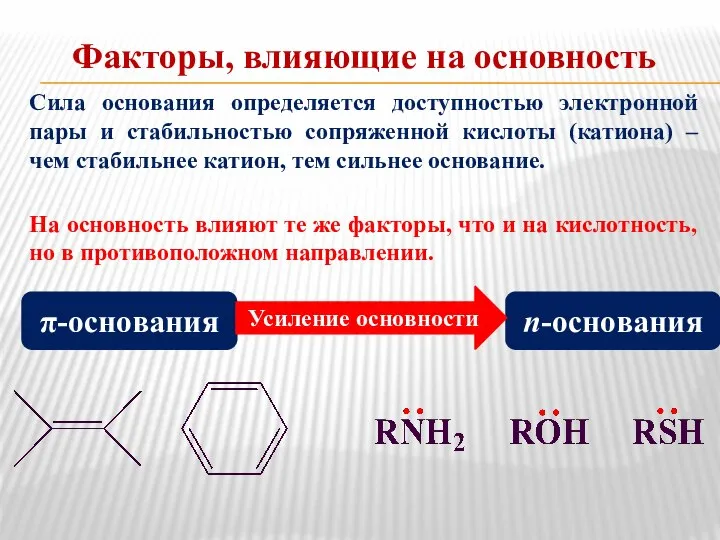
- 8. Факторы, влияющие на основность Сила основания определяется доступностью электронной пары и стабильностью сопряженной кислоты (катиона) –
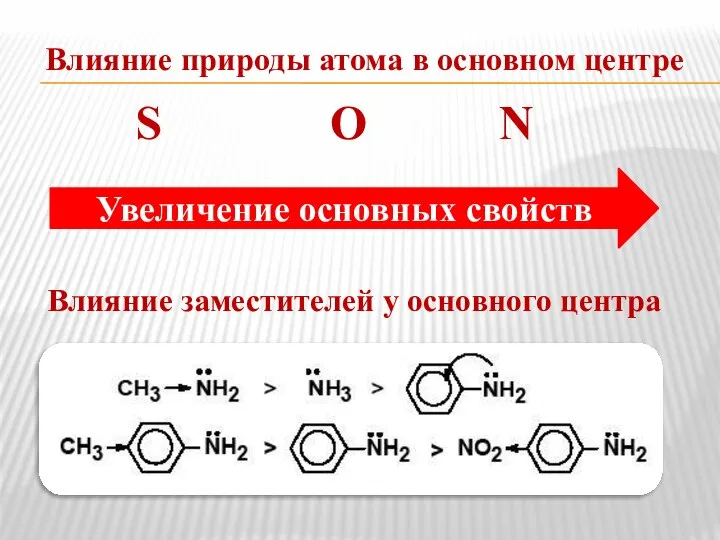
- 9. Влияние природы атома в основном центре S О N Влияние заместителей у основного центра Увеличение основных
- 10. Закономерности влияния заместителей на кислотность и основность Электронодонорные заместители ослабляют кислотность; усиливают основность. Электроноакцепторные заместители усиливают
- 11. Теория Льюиса Кислота - это нейтральная молекула (или ион), являющаяся акцептором электронной пары. Основание - это
- 13. Скачать презентацию




 Альдегиды. Получение и применение
Альдегиды. Получение и применение Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий
Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла Презентация на тему Алкины
Презентация на тему Алкины  Химия. 8 класс
Химия. 8 класс 11кл. 06.10 Презентация по теме _ ПСХЭ Д. И.Менделеева _11 класс
11кл. 06.10 Презентация по теме _ ПСХЭ Д. И.Менделеева _11 класс ОВР химияПрезентация
ОВР химияПрезентация Галогены и их соединения
Галогены и их соединения Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Чему равно общее количество электронов в атоме?
Чему равно общее количество электронов в атоме? Презентация на тему Химия вокруг нас
Презентация на тему Химия вокруг нас  Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Железо
Железо Окислительно - восстановительные реакции
Окислительно - восстановительные реакции Вяжущие вещества
Вяжущие вещества Bool-doser team
Bool-doser team Воздух и его свойства
Воздух и его свойства Строение атома
Строение атома ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски Химия в еде
Химия в еде Презентация на тему Полимеры
Презентация на тему Полимеры  Исследование концентрированных заквасок для сметаны
Исследование концентрированных заквасок для сметаны Сложные вещества. Основания
Сложные вещества. Основания Реакции этерификации
Реакции этерификации 11 класс 15.09
11 класс 15.09 Обмен липидов
Обмен липидов Кислоты в природе и дома. 8 класс
Кислоты в природе и дома. 8 класс 01. Химический состав
01. Химический состав