Содержание
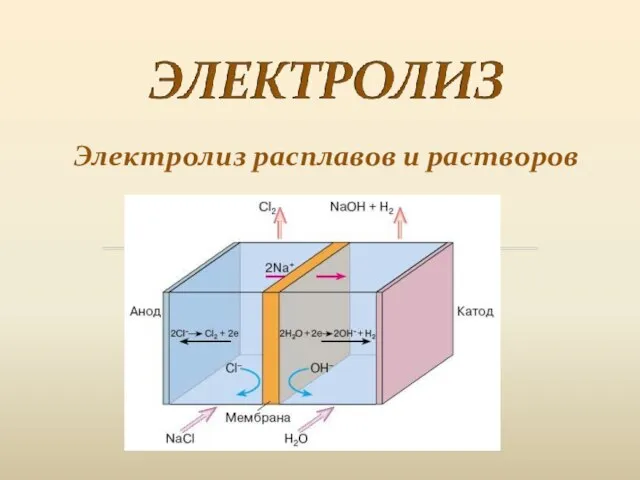
- 2. Электролиз расплавов и растворов
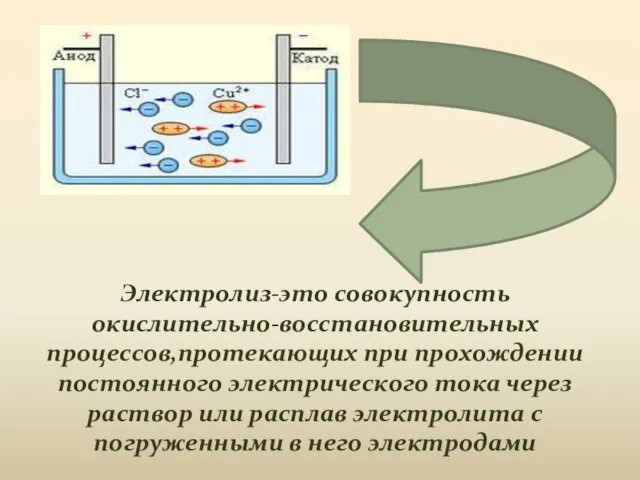
- 3. Электролиз-это совокупность окислительно-восстановительных процессов,протекающих при прохождении постоянного электрического тока через раствор или расплав электролита с погруженными
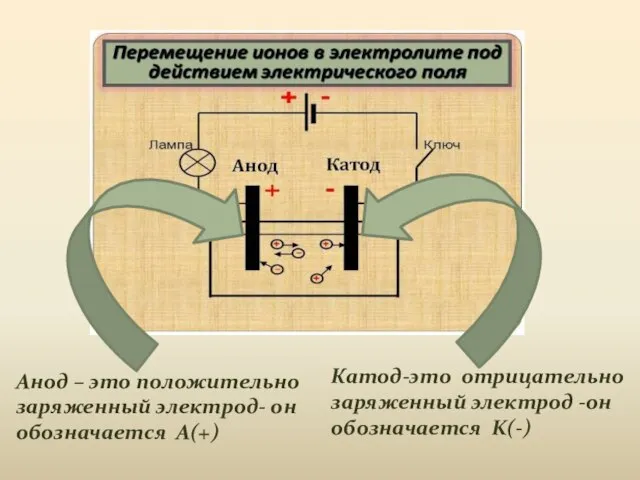
- 4. Катод-это отрицательно заряженный электрод -он обозначается K(-) Анод – это положительно заряженный электрод- он обозначается A(+)
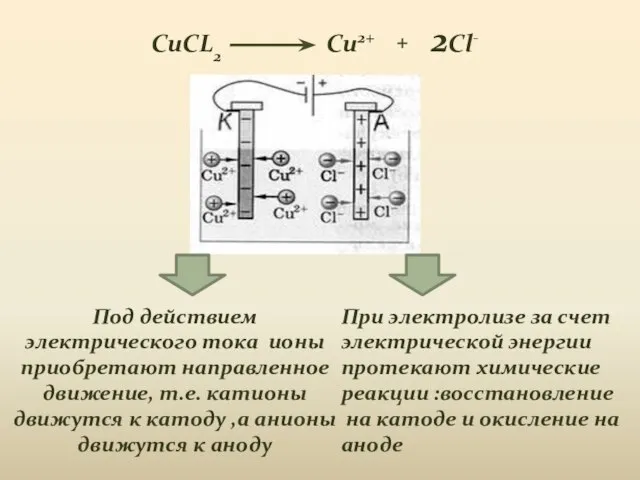
- 5. Под действием электрического тока ионы приобретают направленное движение, т.е. катионы движутся к катоду ,а анионы движутся
- 6. Английский физик и химик, один из основателей электрохимии В конце 18 века он приобрел репутацию хорошего
- 7. Первые его работы в области электрохимии были посвящены изучению действия электрического тока на химические соединения. Он
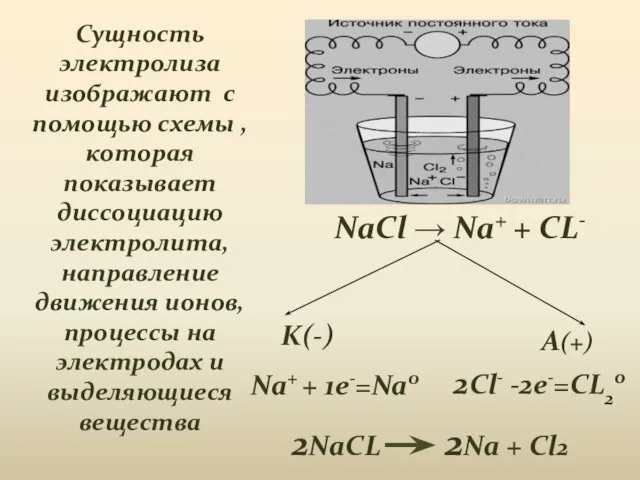
- 8. Сущность электролиза изображают с помощью схемы , которая показывает диссоциацию электролита, направление движения ионов, процессы на
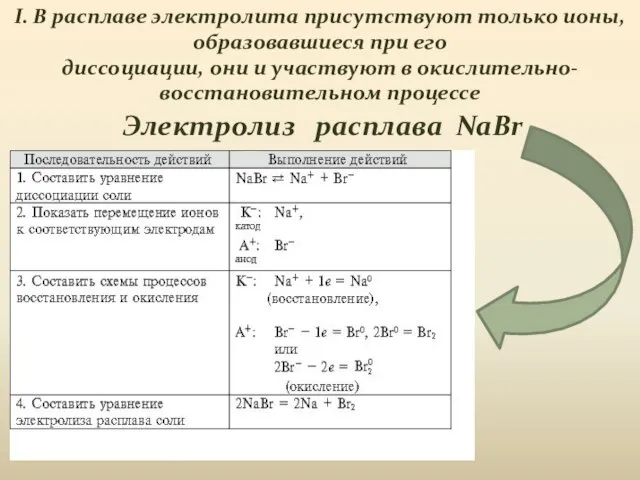
- 9. Электролиз расплава NaBr I. В расплаве электролита присутствуют только ионы, образовавшиеся при его диссоциации, они и
- 10. Электролиз расплава NaOH
- 11. II. Электролиз водного раствора электролита В отличии от расплава в растворе электролита кроме ионов, получившихся при
- 12. MnZnCrFeCoNiSnPb Если у катода накапливаются катионы металла (стоящего в ряду напряжений после H2), то восстанавливаются ионы
- 13. 3) Если у катода накапливаются катионы металла,который расположен в ряду напряжений (после AL и до H2),то
- 14. Последовательность разрядки анионов на аноде зависит от природы аниона: 1) При электролизе растворов солей бескислородных кислот(
- 15. 3) При электролизе растворов щелочей окисляются гидроксид-ионы 4OH- -4e-=O2 +2H2O 2) При электролизе растворов солей кислородосодержащих
- 16. А знаете ли вы, что….. Современную жизнь без электролиза представить себе уже невозможно….
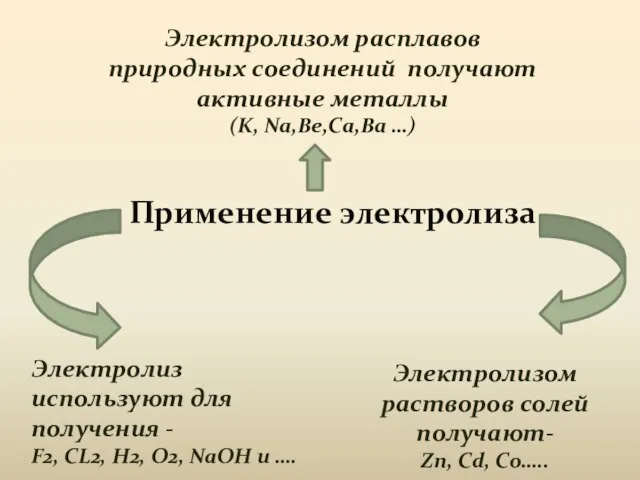
- 17. Применение электролиза Электролизом расплавов природных соединений получают активные металлы (K, Na,Be,Ca,Ba …) Электролизом растворов солей получают-
- 19. Но…..уже в середине XIX века некоторые химики указывали на то, что алюминий можно получать путем электролиза.
- 20. При помощи электролиза монету можно покрыть тонким слоем многих металлов . Но первом фото монета покрыта
- 21. Проверь себя При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется: 1)
- 22. Проверь себя При электролизе водного раствора сульфата меди (II) ( CuSO4) на катоде выделится: А) кислород
- 23. Проверь себя Установите соответствие между формулой соли и продуктом,образующимся на инертном аноде при электролизе ее водного
- 24. Проверь себя Установите соответствие между формулой вещества и продуктом, образующимся на катоде при электролизе его водного
- 25. Проверь себя Установите соответствие между названием вещества и способом его получения Название вещества Получение электролизом А)
- 27. Скачать презентацию

















 Презентация на тему Волокна
Презентация на тему Волокна  Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік
Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік Углеводы
Углеводы Основные понятия и законы химии
Основные понятия и законы химии Углеводороды (УВ)
Углеводороды (УВ) Вещества простые и сложные
Вещества простые и сложные Радиоактивные изотопы
Радиоактивные изотопы Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9
Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9 Номенклатура и изомерия карбоновых кислот
Номенклатура и изомерия карбоновых кислот Соединения серы. Сернистая и серная кислоты
Соединения серы. Сернистая и серная кислоты Осмотическое давление
Осмотическое давление Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями)
Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями) Презентация на тему Неметаллы, особенности строения
Презентация на тему Неметаллы, особенности строения 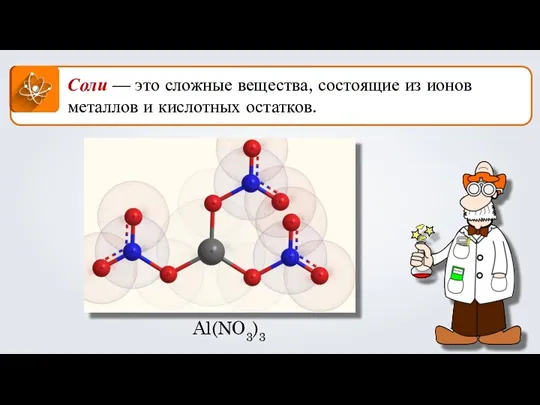 Соли. Формула соли
Соли. Формула соли Презентация на тему Альдегиды
Презентация на тему Альдегиды  Интересные свойства пластика
Интересные свойства пластика Золоторудное поле Дуэт
Золоторудное поле Дуэт Кислоты. Презентация к уроку химии в 8 классе
Кислоты. Презентация к уроку химии в 8 классе Алкины. Номенклатура алкинов
Алкины. Номенклатура алкинов Потенциометрический анализ, титрование
Потенциометрический анализ, титрование Органическая химия
Органическая химия Валентность
Валентность Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Структура и свойства чистого титана
Структура и свойства чистого титана Путешествие в мир кислот
Путешествие в мир кислот Хим-1 презент
Хим-1 презент