является истинным карбидом: всеми четырьмя валентными
связями каждый атом углерода связан с атомами металла. Карбид кальция
является ацетиленидом, так как между углеродными атомами имеется тройная
связь. Поэтому при взаимодействии карбидов алюминия с водой выделяется
метан, а при взаимодействии карбида кальция с водой - ацетилен
4Al4C3+12H2O=4Al(OH)3+3CH4
CaC2+2H2O=Ca(OH)2 +C2H2
Каменный уголь используется как топливо, применяется для получения синтез-газа. Из графита делают электроды, графитовые стержни используется в качестве замедлителя нейтронов в ядерных реакторах. Алмазы используют для изготовления
режущих инструментов, абразивов, ограненные алмазы (бриллианты) являются драгоценными камнями.









 Неметаллы в ПСХЭ
Неметаллы в ПСХЭ Аэрозоли и аэродисперсии
Аэрозоли и аэродисперсии Презентация на тему Обобщение сведений об основных классах неорганических веществ
Презентация на тему Обобщение сведений об основных классах неорганических веществ  задачи
задачи Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс)
Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс) Домашняя работа по теме Фенол
Домашняя работа по теме Фенол Классификация органических соединений
Классификация органических соединений Вывод формул химических веществ
Вывод формул химических веществ Зонная структура металлов, диэлектриков и полупроводников
Зонная структура металлов, диэлектриков и полупроводников Слюда. История открытия
Слюда. История открытия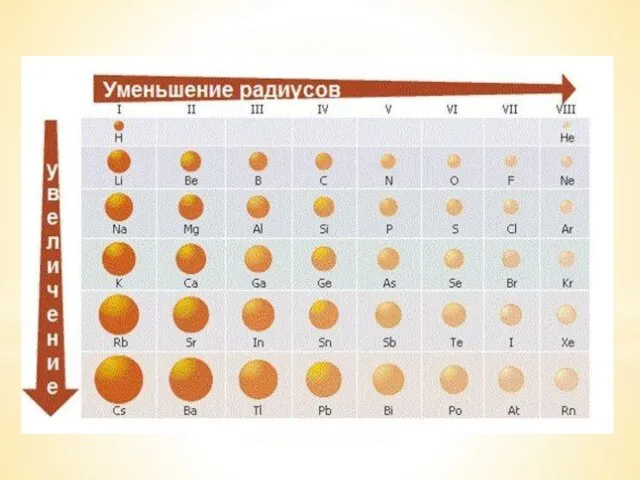 Электроотрицательность химических элементов
Электроотрицательность химических элементов Vielu īpašības
Vielu īpašības Соединения азота
Соединения азота Щелочноземельные металлы
Щелочноземельные металлы Коррозия металлов
Коррозия металлов Электроосмос. Практическое применение электроосмоса
Электроосмос. Практическое применение электроосмоса Физическая химия. Лекция 1. Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической
Физическая химия. Лекция 1. Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии
X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии Галогеналканы и реакции отщепления
Галогеналканы и реакции отщепления Путешествие в страну Металлию. Тест по химии
Путешествие в страну Металлию. Тест по химии Основания
Основания Реакции соединения
Реакции соединения Электролитическая диссоциация. Сванте Август Аррениус (1859 – 1927)
Электролитическая диссоциация. Сванте Август Аррениус (1859 – 1927) Презентация на тему Йод
Презентация на тему Йод  Химические соединения в живых организмах. Неорганические вещества
Химические соединения в живых организмах. Неорганические вещества Дисахариды и полисахариды
Дисахариды и полисахариды Нафта. Походження, переробка, використання
Нафта. Походження, переробка, використання Резиновая краска
Резиновая краска