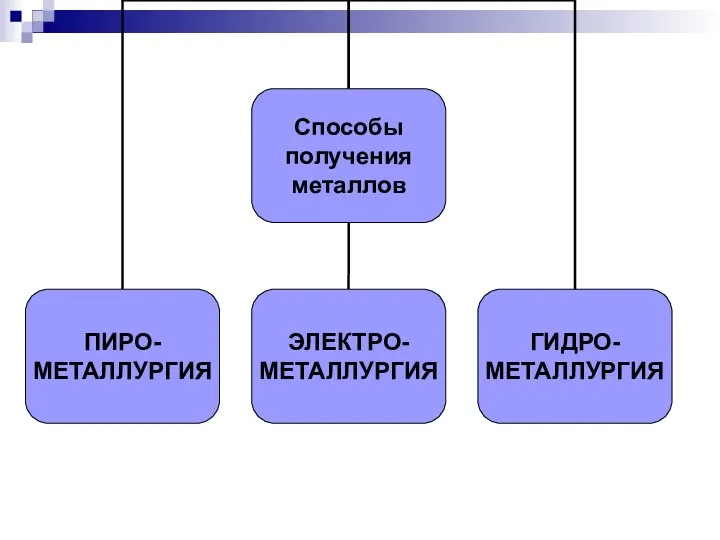
Слайд 2МЕТАЛЛУРГИЯ- промышленный способ
получения металлов.
Только некоторые металлы (золото, платина) находятся в природе

в свободном (самородном) состоянии.
Металлы, расположенные в ряду напряжений металлов между оловом и золотом, встречаются как в свободном состоянии, так и в виде соединений.
Большинство же металлов находятся в природе в виде соединений (оксиды, сульфиды, карбонаты и т.д.)
Слайд 3МЕТАЛЛУРГИЯ
Задача металлургии – получение металлов из их соединений.
Любой металлургический процесс является процес-сом

восстановления ионов металла различными вос-становителями.
Me+n +nē = Me0
В зависимости от метода проведения процесса вос-становления различают несколько способов получе-ния металлов.
Слайд 5ПИРОМЕТАЛЛУРГИЯ - восстановление безвод-ных соединений при высоких температурах.
Восстановители:
углерод и оксид

углерода (II) (карботермия);
алюминий, магний и др.
металлы (металлотермия);
водород (водородотермия).
Слайд 6ПИРОМЕТАЛЛУРГИЯ
Карботермия.
Восстановители: C и CO.
Например: Fe2O3 + 3CO = 2Fe + 3CO2
Если

руда является сульфидом металла, её предварительно перево-дят в оксид путём окислительного обжига (обжиг с доступом воздуха).
Например: 2ZnS + 3O2 = 2ZnO + 2SO2
Затем оксид металла восстанавливают углём.
Например: ZnO + C = Zn + 2CO↑
Так получают: Fe, Cu, Pb, Sn, Cd, Zn
Слайд 7ПИРОМЕТАЛЛУРГИЯ
Металлотермия.
В качестве восстановителей используют химически более активные металлы: Al, Mg, Ca, Na.
Например:

Cr2O3 + 3Al =2Cr + Al2O3
TiCl4 + 2Mg = Ti + 2MgCl2
Обычно получают те металлы (и их сплавы), которые при восстановлении их углём образуют карбиды.
Так получают: Mn, Cr, Ti, Mo, W, V и др.
Слайд 8ПИРОМЕТАЛЛУРГИЯ
Водородотермия.
Восстанавливают металлы из их оксидов H2.
Например: MoO3 + 3H2 = Mo

+ 3H2 O
Оксиды активных металлов (MgO, CaO, Al2O3 и др.) водородом не восстанавливаются.
Получают металлы большей чистоты: Cu, Ni, W, Fe, Mo, Cd, Pb
Слайд 9ЭЛЕКТРОМЕТАЛЛУРГИЯ – восстановление
электрическим током.
Получают главным образом лёгкие металлы – Al, Na

и др. – из их расплавленных оксидов или хлоридов.
Используют также для очистки
некоторых металлов.
Из очищаемого металла изготав-
ливают анод. При электролизе
анод растворяется, ионы металла
переходят в раствор, а на катоде
они осаждаются. Так получают
электролитически чистые металлы:
Cu, Ag, Fe, Ni, Pb и многие другие.
Слайд 10ЭЛЕКТРОМЕТАЛЛУРГИЯ
Электролиз расплавов.
Например: t
NaCl = Na+ + Cl-
расплав
K Na+

+ ē = Na0 2
A 2Cl- - 2ē = Cl2↑ 1
эл-лиз
2NaСl → 2Na + Cl2↑
Получаемые металлы: Be, Mg, Ca (из расплавленных хлоридов), Al (из расплавленного оксида)
Слайд 11ЭЛЕКТРОМЕТАЛЛУРГИЯ
Электролиз растворов.
Например:
NiSO4 = Ni2+ + SO42-
раствор
K Ni2+

+2ē = Ni0 2
A 2H2O - 4ē = O2↑ + 4H+ 1
эл-лиз
2NiSO4 + 2H2O → 2Ni + O2↑ + 2H2SO4
Получаемые металлы: Zn, Cd, Co, Mn, Fe
Слайд 12ГИДРОМЕТАЛЛУРГИЯ – восстановление из растворов солей.
Металлы, входящие в состав руды, переводят

в раствор, а затем восстанавливают более активным металлом.
Слайд 13ГИДРОМЕТАЛЛУРГИЯ
Восстановление металлов из руд с помощью серной кис-лоты – один из

основных процессов гидрометаллур-гии.
Например:
CuO + H2SO4 = CuSO4+ H2O
CuSO4 + Fe = FeSO4 + Cu
Получаемые металлы: Cd, Ag, Au, Cu, Zn, Mo и др.
Слайд 14Примеры заданий по теме: «Общие способы получение металлов».
Задания с выбором ответа (

А10, А24, А29).
А1. Реакция возможна между
1) Ag и K2SO4 (р-р)
2) Zn и KCl (р-р)
3) Mg и SnCl2 (р-р)
4) Ag и CuSO4 (р-р)
А2. Какой из металлов вытесняет железо из сульфата
железа (II)?
1) Cu 2) Zn 3) Sn 4) Hg
Слайд 15Примеры заданий по теме: «Общие способы получение металлов».
A3. Какой из металлов вытесняет

медь из сульфата ме-
ди (II)?
1) Zn 2) Ag 3) Hg 4) Au
A4. Формула вещества, восстанавливающего оксид ме-
ди (II), - это
1) CO2 2) H2 3) HNO3 4) Cl2
A5. Формула вещества, не восстанавливающего оксид
железа (III), -
1) HCl 2) Al 3) H2 4) C
Слайд 16Примеры заданий по теме: «Общие способы получение металлов».
А6. Для осуществления превращений в

соответствии со схемой:
Al(OH)3 → AlCl3 → Al необходимо последовательно использовать
1) хлор и водород
2) хлорид натрия и водород
3) хлороводород и цинк
4) соляную кислоту и калий
А7. Пирометаллургический метод получения металлов отражает реакция:
1) HgS + O2 → Hg + SO2
2) CuSO4 + Fe → FeSO4 + Cu
Эл - из
3) 2NaCl ----→ 2Na + Cl2
4) CuSO4 + Zn → ZnSO4 + Cu
Слайд 17Примеры заданий по теме: «Общие способы получение металлов».
А8. Гидрометаллургический метод получения металлов

отражает реакция:
1) HgS + O2 → Hg + SO2
2) CuSO4 + Fe → FeSO4 + Cu
Эл - из
3) 2NaCl ------→ 2Na + Cl2
4) AlCl3 + 3K → Al + 3KCl
А9. В качестве восстановителя при выплавке железа в промышленности
наиболее часто используют
1) водород
2) алюминий
3) натрий
4) кокс
Слайд 18Примеры заданий по теме: «Общие способы получение металлов».
А10. Оксид углерода (II) проявляет

восстановительные
свойства при нагревании с
1) N2
2) H2S
3) Fe
4) Fe2O3
Слайд 19Примеры заданий по теме: «Общие способы получение металлов».
Задания с кратким ответом (В3).
В1.

При электролизе раствора AgNO3 на катоде выделяется
1) серебро
2) водород
3) серебро и водород
4) кислород и водород
Слайд 20Примеры заданий по теме: «Общие способы получение металлов».
В2. Установите соответствие между формулой

вещества и
продуктом электролиза его водного раствора
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
ВОДНОГО РАСТВОРА
А) AgF 1) Ag, F2
Б) NaNO3 2) Ag, O2, HF
B) Pb(NO3)2 3) H2, O2
Г) NaF 4) Pb, O2, HNO3
5) H2, NO2, O2
6) NaOH, H2, F2
А Б В Г
2 3 4 3
Слайд 21Примеры заданий по теме: «Общие способы получение металлов».
В3. Установите соответствие между формулой

вещества и продук- том электролиза его водного раствора
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
ВОДНОГО РАСТВОРА
А) HgCl2 1) металл, хлор
Б) AlCl3 2) водород, хлор, гидроксид
В) Hg(ClO4)2 металла
Г) Na2SO3 3) водород, кислород
4) металл, кислород, кислота
5) металл, сернистый газ
6) водород, сернистый газ
Слайд 22Примеры заданий по теме: «Общие способы получение металлов».
В4. Установите соответствие между формулой

вещества и продук-том электролиза его водного раствора
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
ВОДНОГО РАСТВОРА
А) нитрат цинка 1) цинк, кислород, азотная кислота
Б) бромид цинка 2) водород, кислород
В) бромид калия 3) водород, оксид азота (IV)
Г) нитрат калия 4) цинк, бром
5) водород, бром, гидроксид калия
6) калий, бром
7) калий, оксид азота (IV)
Слайд 23Примеры заданий по теме: «Общие способы получение металлов».
В5. Установите соответствие между формулой

вещества и продук-том электролиза его водного раствора, образующимся на като-де
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
ВОДНОГО РАСТВОРА
А) Li2SO4 1) H2
Б) Ba(OH)2 2) O2
В) MgCl2 3) Cl2
Г) SnCl2 4) Li
5) Ba
6) Mg
7) Sn
Слайд 24Примеры заданий по теме: «Общие способы получение металлов».
В6. Верны ли следующие суждения

о промышленных способах
получения металлов?
А. В основе пирометаллургии лежит процесс восстановления
металлов из руд при высоких температурах.
Б. В промышленности в качестве восстановителей используют
оксид углерода (II) и кокс.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Слайд 25Примеры заданий по теме: «Общие способы получение металлов».
В7. Установите соответствие между металлом

и способом его
электролитического получения.
МЕТАЛ ЭЛЕКТРОЛИЗ
А) натрий 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) серебро 3) расплава поваренной соли
Г) медь 4) расплавленного оксида
5) раствора оксида в расплав-
ленном криолите
6) расплавленного нитрата
Слайд 26Примеры заданий по теме: «Общие способы получение металлов».
В8. Установите соответствие между металлом

и способом его
электролитического получения.
МЕТАЛ ЭЛЕКТРОЛИЗ
А) калий 1) расплавленного нитрата
Б) магний 2) водного раствора гидроксида
В) медь 3) расплава хлорида
Г) свинец 4) расплавленного оксида
5) раствора оксида в расплав-
ленном криолите
6) водного раствора солей
Слайд 27Примеры заданий по теме: «Общие способы получение металлов».
В9. Установите соответствие между металлом

и способом его
электролитического получения.
МЕТАЛ ЭЛЕКТРОЛИЗ
А) хром 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) литий 3) расплава соли
Г) барий 4) расплавленного оксида
5) раствора оксида в расплав-
ленном криолите
6) расплавленного нитрата
Слайд 28Примеры заданий по теме: «Общие способы получение металлов».
Задания с развёрнутым ответом (С2).
С1.

Напишите уравнения реакций, с помощью которых
можно осуществить превращения:
Cu → Cu(NO3)2 → Cu(OH)2 → Х → Сu → CuSO4
Укажите условия протекания реакций.
C2. Даны вещества: алюминий, оксид марганца (IV),
водный раствор сульфата меди и концентриро-
ванная соляная кислота.
Напишите уравнения четырёх возможных реакций
между этими веществами.
Слайд 29Примеры заданий по теме: «Общие способы получение металлов».
С3. Напишите уравнения реакций, протекающих

на катоде и аноде, а также общее уравнение электроли-за водного раствора сульфата ртути (II) на инертных электродах.
С4. При электролизе водного раствора сульфата хрома (III) на катоде возможны три химические реакции. Напишите уравнения этих катодных процессов.
Слайд 30Список литературы.
1. Химия. ЕГЭ – 2003. Контрольные измерительные материалы единого государственного экзамена

в 2003 году.М.: ЦТМОР, 2003.
2. Химия. Учебно – тренировочные материалы для подготовки к единому государственному экзамену. М.: Интеллект-Центр. 2004.
3. Химия. ЕГЭ 2005-2006. Контрольные измерительные материалы единого государственного экзамена. – М.: Просвещение, 2006.
4. Химия. Учебно – тренировочные материалы для подготовки к единому государственному экзамену. М.: Интеллект-Центр. 2006.
Слайд 31Список литературы.
5. Химия. Учебно – тренировочные материалы для подготовки к единому государственному

экзамену. М.: Интеллект-Центр. 2007.
6. Химия. ЕГЭ – 2008. Экзаменационные матероиалы для подготовки к единому государственному экзамену. М.: ФГУ «Федеральный цент тестирования», 2007.
7. Химия. 10 класс / И.И.Новошинский, Н.С. Новошинская. – Краснодар: Совет. Кубань, 2006.
8. Химия (для подготовителдьных отделений): Учебник.- 2-е изд., перераб. и доп. – М.: Высш. Шк., 1998.
9. Химия. ЕГЭ 2008. типовые тестовые задания / Ю.Н.Медведев.
М.: Издательство «Экзамен», 2008.
10. Химия. ЕГЭ 2009. Универсальные материалы для подготовки
учащихся / ФИПИ. – М.: Интелект-Центр, 2009.





























 Технологические особенности никеля и никелевых сплавов
Технологические особенности никеля и никелевых сплавов Карбоновые кислоты. Сложные эфиры. Жиры
Карбоновые кислоты. Сложные эфиры. Жиры Ионная связь
Ионная связь Массовая доля вещества в растворе
Массовая доля вещества в растворе Презентация на тему Неорганическая химия: подготовка к ГИА
Презентация на тему Неорганическая химия: подготовка к ГИА  Предмет химии. Один из способов познания окружающего мира, основанный на объективных данных
Предмет химии. Один из способов познания окружающего мира, основанный на объективных данных Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Ренгеноструктурный и рентгеноспектральный анализы
Ренгеноструктурный и рентгеноспектральный анализы Диффузия золота и свинца
Диффузия золота и свинца Получение аммиака и изучение его свойств. Практическая работа № 2
Получение аммиака и изучение его свойств. Практическая работа № 2 Презентация по Химии "Фосфор - элемент жизни и мысли"
Презентация по Химии "Фосфор - элемент жизни и мысли"  Тренажер. Химические свойства солей
Тренажер. Химические свойства солей Природные смолы: мирра, ладан и шеллак
Природные смолы: мирра, ладан и шеллак Направление химических реакций
Направление химических реакций Учёные-химики в годы Великой Отечественной войны
Учёные-химики в годы Великой Отечественной войны Разнообразие веществ. 3 класс
Разнообразие веществ. 3 класс Степень окисления. Составление формул бинарных соединений
Степень окисления. Составление формул бинарных соединений Оксиды и гидроксиды металлов
Оксиды и гидроксиды металлов Тепловой эффект химических реакций
Тепловой эффект химических реакций Типы химических реакций
Типы химических реакций Спирты. Общая формула, номенклатура
Спирты. Общая формула, номенклатура Модель Томпсона. Модель Резерфорда
Модель Томпсона. Модель Резерфорда Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества Основные законы химии
Основные законы химии Аминокислоты
Аминокислоты Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Проверочные работы по темам: Неметаллы. 9 класс
Проверочные работы по темам: Неметаллы. 9 класс Анилин - представитель ароматических аминов
Анилин - представитель ароматических аминов