Содержание
- 2. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Порядковый номер. Химический
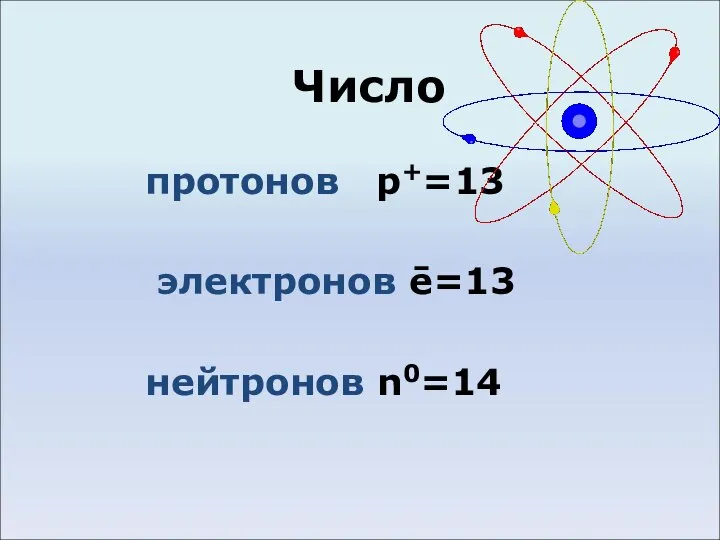
- 3. Число протонов p+=13 электронов ē=13 нейтронов n0=14
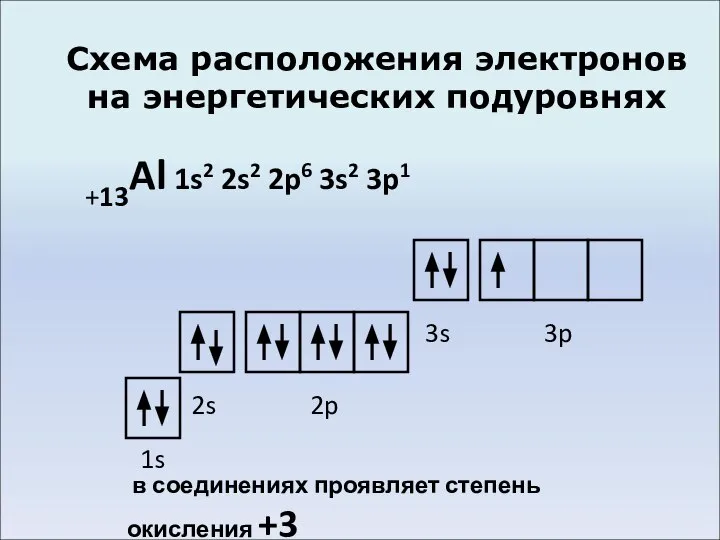
- 4. Схема расположения электронов на энергетических подуровнях +13Al 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s
- 5. Al – типичный металл Восстановительные свойства Al 0- 3ē Al+3 Тип химической связи -металлическая Тип кристаллической
- 6. Физические свойства вещества Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает
- 7. Особенности физических и химических свойств алюминия, его нахождения в природе и применения: Алюминий – самый распространенный
- 8. Алюминий реагирует с простыми веществами - неметаллами 4Al+3O2 = 2Al2O3 Поверхность покрывается пленкой оксида, в мелкораздробленном
- 9. Алюминий реагирует со сложными веществами: Алюминий растворяется в растворах кислот 2Al + 6HCl = 2AlCl3 +
- 10. Алюминий реагирует со сложными веществами: 3. Алюминий при высокой температуре реагирует с оксидами менее активных металлов
- 11. Алюминий реагирует со сложными веществами: 4.Так как алюминий – амфотерный металл, он реагирует с растворами щелочей.
- 12. Получение алюминия Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6) и электролизом расплава AlCl3
- 13. Применение Al
- 14. Соединения алюминия В природе алюминий встречается только в виде соединений и по распространенности в земной коре
- 15. Оксид алюминия Al2О3: Очень твердый (корунд, рубин)в кристаллическом состоянии, порошок белого цвета, тугоплавкий - 20500С. Не
- 16. Белый нерастворимый в воде порошок. Проявляет амфотерные свойства, взаимодействует: а) с кислотами Al (OH)3 + 3HCl
- 18. Скачать презентацию












 Подгруппа алюминия
Подгруппа алюминия Щелочные металлы
Щелочные металлы Металлы и их соединения
Металлы и их соединения Структура материалов
Структура материалов История развития органической химии. 10 класс
История развития органической химии. 10 класс Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"
Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"  Презентация по Химии "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»"
Презентация по Химии "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»"  Санитарно-гигиенические показатели питьевой воды
Санитарно-гигиенические показатели питьевой воды Классификация методов аналитической химии
Классификация методов аналитической химии Материаловедение
Материаловедение 9_OSNOVY_KOLANALIZA (1)
9_OSNOVY_KOLANALIZA (1) Комплексные соединения
Комплексные соединения Кислоты. Оксиды
Кислоты. Оксиды Валентность
Валентность Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям  Алюминийорганические соединения
Алюминийорганические соединения Свине́ц (Plumbum;Pb)
Свине́ц (Plumbum;Pb) Таблица Менделеева
Таблица Менделеева Céramiques lesquelles choisi ?
Céramiques lesquelles choisi ? Процестер және аппараттар курсының пәні (1 дәріс)
Процестер және аппараттар курсының пәні (1 дәріс) алотропні модифікації неметалів
алотропні модифікації неметалів Гидролиз солей. Лекция №18
Гидролиз солей. Лекция №18 Зависимость скорости от температуры
Зависимость скорости от температуры Кислородные соединения углерода
Кислородные соединения углерода Оксиды
Оксиды Диеновые углеводороды
Диеновые углеводороды Презентация на тему Вредное воздействие нитратов на организм человека
Презентация на тему Вредное воздействие нитратов на организм человека  Разработка математического описания расчета октанового числа бензинов каталитического риформинга с групповой кинетикой
Разработка математического описания расчета октанового числа бензинов каталитического риформинга с групповой кинетикой