Содержание
- 2. План урока: Строение атома Заряд и массовое число элемента Изотопы Значение закона Мозли Строение атома элемента
- 3. Строение атома
- 4. Заряд и массовое число элемента
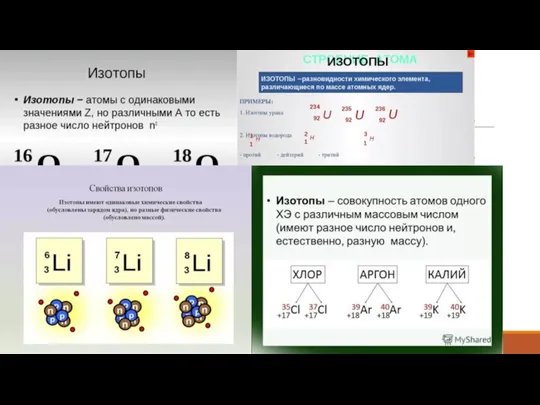
- 5. Изотопы
- 7. В некоторых случаях у элементов с большим порядковым номером атомная масса меньше, чем у элементов с
- 8. Разница между а. е. м. элемента и массовым числом изотопа Значения массового числа – целое число,
- 9. Значение закона Мозли Благодаря работам Мозли было установлено, что истинная причина периодического изменения свойств элементов являются
- 10. Строение атома элемента Энергетический уровень (электронный слой) – местонахождение электронов с одинаковым запасом энергии. Максимальное количество
- 12. Скачать презентацию








 Химическая связь
Химическая связь Основные понятия химической термодинамики
Основные понятия химической термодинамики Электрическая диссоциация
Электрическая диссоциация Использование национально-регионального компонента по химии для основной школы
Использование национально-регионального компонента по химии для основной школы Ионизирующее излучение и окружающая среда
Ионизирующее излучение и окружающая среда Презентация по Химии "Схема получения моноизотопного кремния"
Презентация по Химии "Схема получения моноизотопного кремния"  Относительная атомная масса. Массы атомов
Относительная атомная масса. Массы атомов Роль нитрадов. Взгляд специалистов
Роль нитрадов. Взгляд специалистов Спирты. Методы получения
Спирты. Методы получения Электролиз воды
Электролиз воды Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания
Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Соли, их классификация и свойства
Соли, их классификация и свойства Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи
Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи Химические свойства алканов
Химические свойства алканов Композиционные материалы. Структура и свойства
Композиционные материалы. Структура и свойства Сплавы металлов
Сплавы металлов Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Алкины. Строение
Алкины. Строение Химический анализ воды
Химический анализ воды Электролиз (катод)
Электролиз (катод) Способы получения чистых веществ в лаборатории
Способы получения чистых веществ в лаборатории Čo sú chemické reakcie
Čo sú chemické reakcie Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Химические волокна. Урок 1-2
Химические волокна. Урок 1-2 Предмет органической химии
Предмет органической химии Разбор 25 задания. Вебинариум
Разбор 25 задания. Вебинариум