Содержание
- 2. Цель На этом уроке мы поведем разговор о простых веществах – неметаллах, их химических свойствах. Вы
- 3. Входной контроль 1. Горящая свеча гаснет в закрытой пробкой банке, потому что: 1) не хватает кислорода
- 4. Входной контроль 2. В какой из реакций сера проявляет восстановительные свойства свойства 1) S + H2
- 5. Входной контроль 3. Какая из реакций не существует 1) 2KI + CI2 = 2KCI + I2
- 6. Входной контроль 4. Уголь реагирует с веществами набора: 1) кислород, угарный газ; 2) кислород, медь; 3)
- 7. Входной контроль 5. Азот реагирует: 1) со щелочью; 2) с активными металлами; 3) со фтором; 4)
- 8. Ответы: 1 - 1 2 - 2 3 - 2 4 - 3 5 – 2
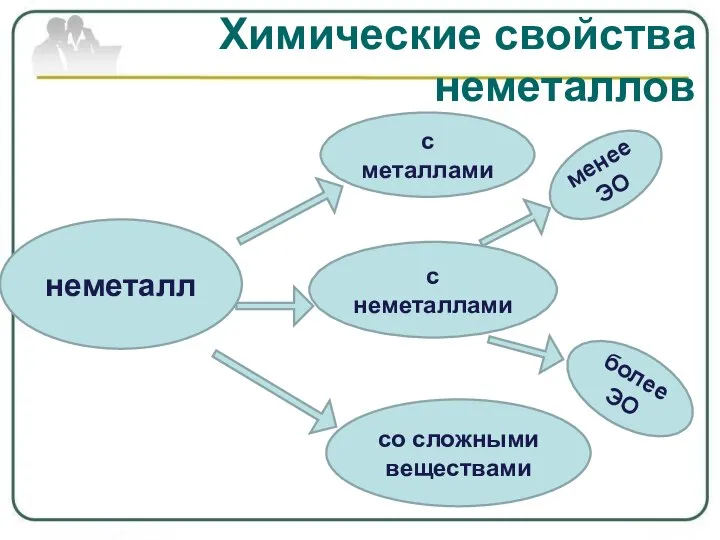
- 9. неметалл с металлами с неметаллами со сложными веществами менее ЭО более ЭО Химические свойства неметаллов
- 10. Характерными для большинства неметаллов являются окислительные свойства. Как окислители неметаллы реагируют - с металлами: Ca +
- 11. Химические свойства неметаллов Проверьте составленные вами уравнения Ca + Cl2 = CaCl2 2Mg + Si =
- 12. - с менее электротрицательными неметаллами: H2 + S = C + S = P4 + O2
- 13. Химические свойства неметаллов - со сложными веществами: FeCl2 + Cl2 = NaBr + Cl2 = CH4
- 14. Химические свойства неметаллов Неметаллы, как восстановители - реагируют с кислородом и фтором S + F2 =
- 15. Химические свойства неметаллов реагируют с кислотами окислителями (H2SO4(конц) и HNO3 ) неМе + H2SO4(конц) = к-та(max
- 16. Химические свойства неметаллов HNO3 окисляет неМе до соответствующих кислот У HNO3 (конц) азот восстанавливается до NO2
- 17. Химические свойства неметаллов для углерода и водорода как восстановителей характерно взаимодействие с оксидами Ме и неМе
- 18. Химические свойства неметаллов Реакции диспропорционирования - галогены (кроме фтора) и сера при взаимодействии со щелочами -
- 19. Выходной контроль 1. Простое вещество азот взаимодействует с каждым из веществ группы: а) Н2О, СО2, NaOH
- 20. Выходной контроль 2. Простое вещество сера взаимодействует с каждым из веществ группы: а) HCl, Na, O2,
- 21. Выходной контроль 3.Схеме превращения: N+2 → N+4 соответствует химическое уравнение: а) N2 + 3Mg = Mg3N2
- 22. Выходной контроль 4. Запишите химические формулы и названия веществ А и В в схеме превращений: +O2
- 23. Выходной контроль 5. Составьте уравнения реакций по следующей схеме: N2 → NH3 → NH4OH → (NH4
- 24. Д.З. § 34.3 № 4 – 7 стр.241 Спасибо за сотрудничество
- 25. Б 2. Серебряную проволоку растворили в азотной кислоте. К полученному раствору добавили избыток гидроксида натрия. Укажите
- 26. Входной контроль 3. Не взаимодействуют между собой диоксид кремния и 1) вода 2) магний 3) оксид
- 27. 6 (2 балла). Оксид серы (VI) не взаимодействует с веществом, формула которого: А. СО2. Б. Н2О.
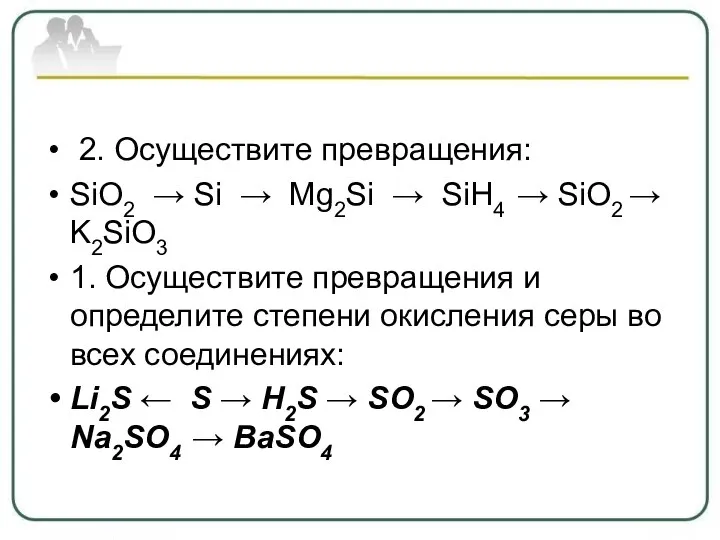
- 28. 2. Осуществите превращения: SiO2 → Si → Mg2Si → SiH4 → SiO2 → K2SiO3 1. Осуществите
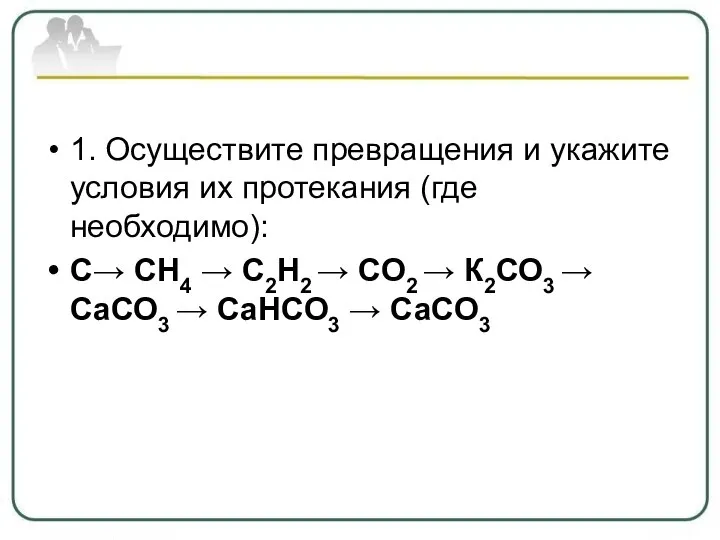
- 29. 1. Осуществите превращения и укажите условия их протекания (где необходимо): С→ СН4 → С2Н2 → СО2
- 31. Скачать презентацию
























 Электролиз (катод)
Электролиз (катод) Минералы алюминия
Минералы алюминия Электролиз. Применение электролиза
Электролиз. Применение электролиза Химический состав живых организмов. Метаболизм
Химический состав живых организмов. Метаболизм Сера
Сера Алюминий. Из истории открытия
Алюминий. Из истории открытия Химическое сопротивление материалов
Химическое сопротивление материалов Селективная экстракция отдельных групп БАВ сверхкритическими флюидами
Селективная экстракция отдельных групп БАВ сверхкритическими флюидами Использование комбинаторных задач для подсчета вероятностей
Использование комбинаторных задач для подсчета вероятностей Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Насыщенные жирные кислоты
Насыщенные жирные кислоты Презентация на тему Пластмасса
Презентация на тему Пластмасса  Химия в косметологии
Химия в косметологии Получение карбоновых кислот
Получение карбоновых кислот Азот. Аммиак. Соли аммония (1)
Азот. Аммиак. Соли аммония (1) Химия цвета
Химия цвета Валентность. Что же это такое?
Валентность. Что же это такое? ЛК 2_окислительно-восстановительные процессы
ЛК 2_окислительно-восстановительные процессы Пример выполнения проверочной работы по теме углеводороды
Пример выполнения проверочной работы по теме углеводороды Установка ЛЧ-35-11/600. Блок Гидроочистки
Установка ЛЧ-35-11/600. Блок Гидроочистки Свойства кислорода. Оксиды
Свойства кислорода. Оксиды Презентация на тему Химия в повседневной жизни человека
Презентация на тему Химия в повседневной жизни человека  Тотығу - тотықсыздану реакциясы
Тотығу - тотықсыздану реакциясы Углеводы: моно-, ди-, полисахариды
Углеводы: моно-, ди-, полисахариды Презентация на тему Природные источники углеводородов (9 класс)
Презентация на тему Природные источники углеводородов (9 класс)  Презентация на тему Угольная и кремниевая кислоты и их соли
Презентация на тему Угольная и кремниевая кислоты и их соли  Презентация на тему М.В. Ломоносов
Презентация на тему М.В. Ломоносов  Кристаллическая структура вещества. Характеристика вещества по формуле
Кристаллическая структура вещества. Характеристика вещества по формуле