Содержание
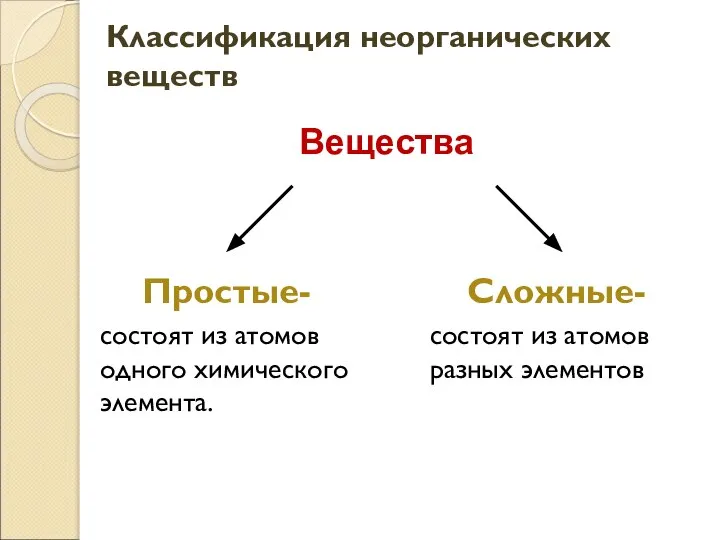
- 2. Классификация неорганических веществ Простые- состоят из атомов одного химического элемента. Сложные- состоят из атомов разных элементов
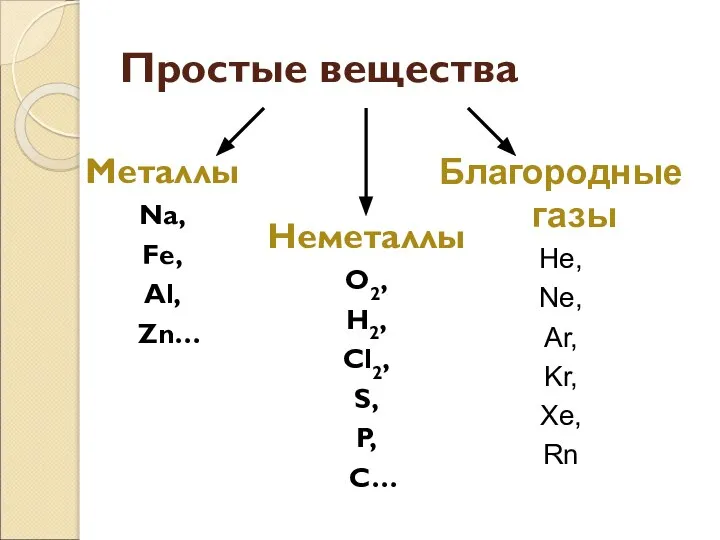
- 3. Благородные газы He, Ne, Ar, Kr, Xe, Rn Простые вещества Металлы Na, Fe, Al, Zn… Неметаллы
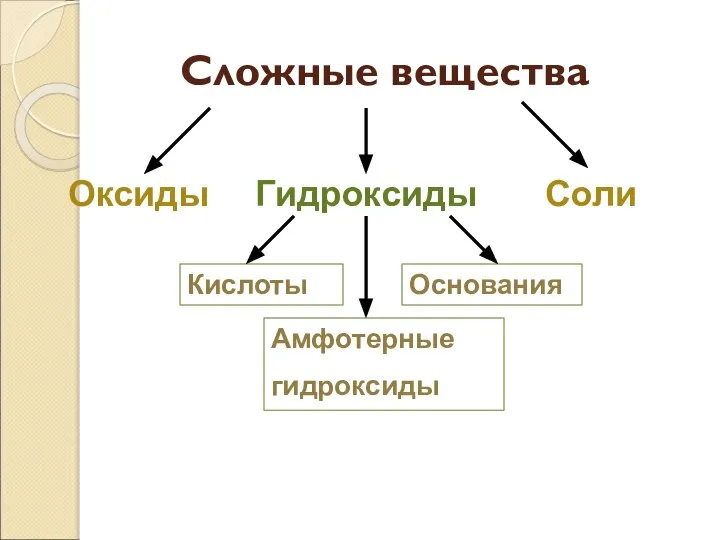
- 4. Сложные вещества Оксиды Гидроксиды Соли Кислоты Основания Амфотерные гидроксиды
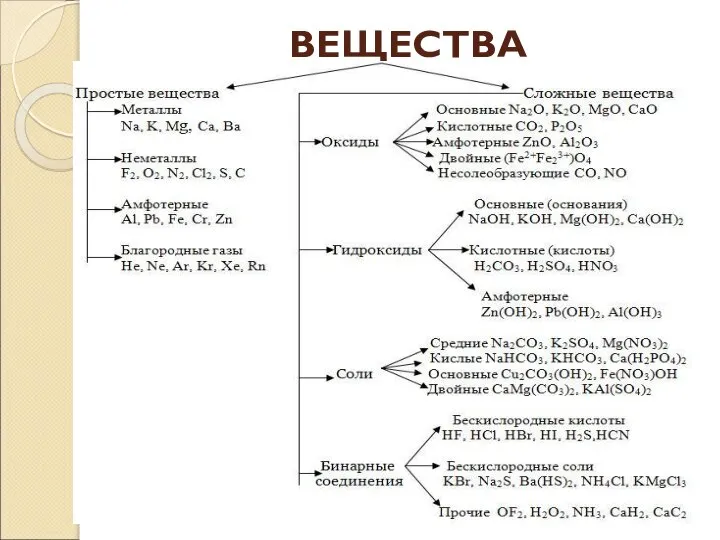
- 5. ВЕЩЕСТВА
- 6. Оксиды Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород
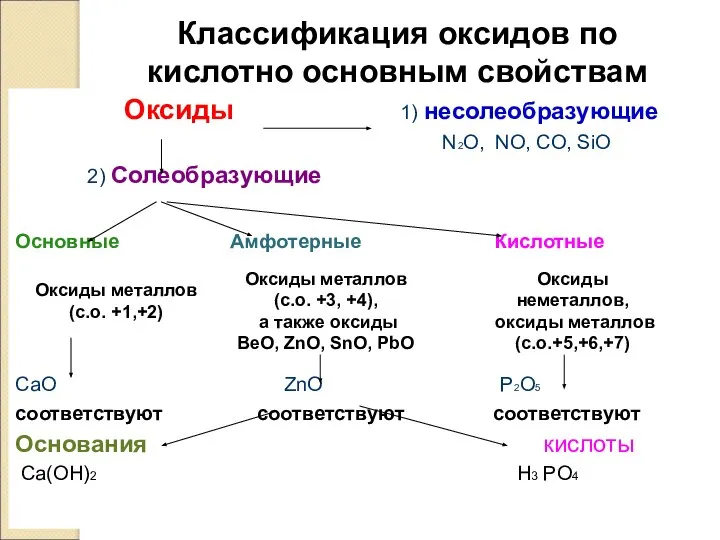
- 7. Классификация оксидов по кислотно основным свойствам Оксиды 1) несолеобразующие N2O, NO, CO, SiO 2) Солеобразующие Основные
- 8. Несолеобразующие оксиды — оксиды, не проявляющие ни кислотных, ни основных, ни амфотерных свойств и не образующие
- 9. Общая формула Ме2О, МеО Физические свойства При комнатной температуре основные оксиды твердые, кристаллические вещества чаще всего
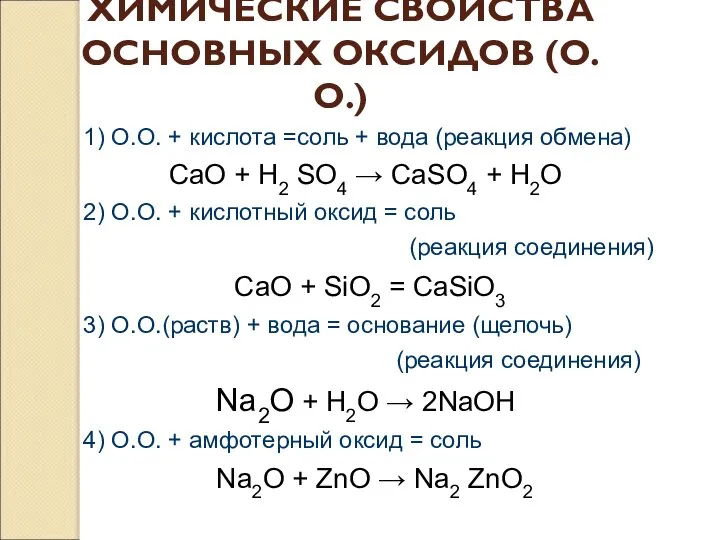
- 10. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.) 1) О.О. + кислота =соль + вода (реакция обмена) CaO +
- 11. Агрегатное состояние различное: Р2О5 – твердый, SiO2 – твердый, СО2 – газообразный, SO3 – жидкий при
- 12. Химические свойства кислотных оксидов (К.О.) 1) К.О. + основание = соль + вода (реакция обмена) CO2
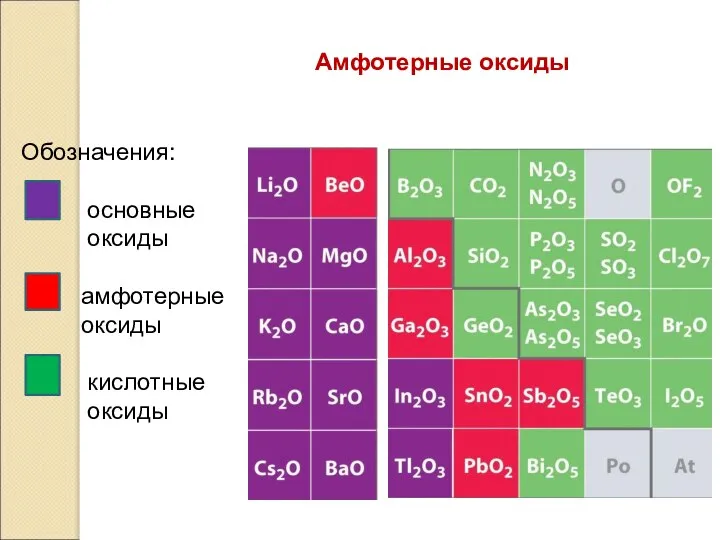
- 13. Амфотерные оксиды Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Примеры:
- 14. Al2O3 (оксид алюминия) очень твердые прозрачные кристаллы. Температура плавления – 2053 °C, температура кипения – 3000
- 15. Амфотерные оксиды Обозначения: основные оксиды амфотерные оксиды кислотные оксиды
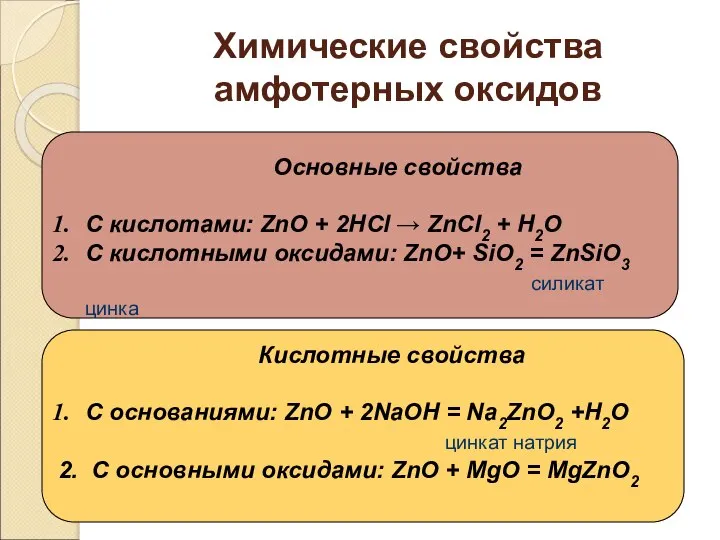
- 16. Химические свойства амфотерных оксидов Основные свойства С кислотами: ZnO + 2НСl → ZnСl2 + Н2О С
- 17. Способы получения оксидов 1) Взаимодействие простых веществ с кислородом. S + O2—› SO2 4Al + 3O2
- 19. Скачать презентацию








 Галогены
Галогены Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Ko pēta ķīmija
Ko pēta ķīmija Периодическая система химических элементов Д.И.Менделеева I
Периодическая система химических элементов Д.И.Менделеева I Строение электронных оболочек атомов элементов
Строение электронных оболочек атомов элементов презентация арены 1
презентация арены 1 VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии
VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии Углеводороды
Углеводороды Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Экстракция
Экстракция Железо. 9 класс
Железо. 9 класс Гидролиз солей
Гидролиз солей Фосфор. Элемент жизни и мысли
Фосфор. Элемент жизни и мысли Гемоглобин. Структура и свойства молекулы гемоглобина
Гемоглобин. Структура и свойства молекулы гемоглобина Уровень С1 в ГИА
Уровень С1 в ГИА Липиды. Функции липидов
Липиды. Функции липидов Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа
Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа Презентация на тему Артур Конан-Дойл «Собака Баскервилей»
Презентация на тему Артур Конан-Дойл «Собака Баскервилей»  Любовь и химия
Любовь и химия Презентация на тему Жизнь и деятельность Д.И. Менделеева
Презентация на тему Жизнь и деятельность Д.И. Менделеева  Презентация на тему Влияние химических веществ на рост и развитие растений
Презентация на тему Влияние химических веществ на рост и развитие растений  Простые и сложные вещества (8 класс)
Простые и сложные вещества (8 класс) Опыты по теме Свойства основных классов неорганических соединений
Опыты по теме Свойства основных классов неорганических соединений Введение. Тренажер
Введение. Тренажер Разбор 25 задания. Вебинариум
Разбор 25 задания. Вебинариум Основные химические понятия и законы химии. (Часть 1)
Основные химические понятия и законы химии. (Часть 1) Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Алкены
Алкены