Содержание
- 2. Цели работы: Изучить процесс производства аммиака Изучить условия протекания реакции Изучить пользу и вред производства
- 3. Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах
- 4. Промышленное получение аммиака Условия протекания реакции Современная установка синтеза аммиака Поиск катализатора Итог исследований Ф. Габер
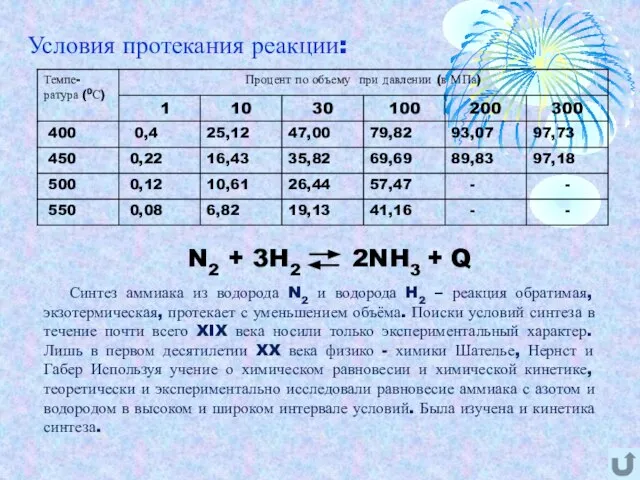
- 5. Условия протекания реакции: Синтез аммиака из водорода N2 и водорода H2 – реакция обратимая, экзотермическая, протекает
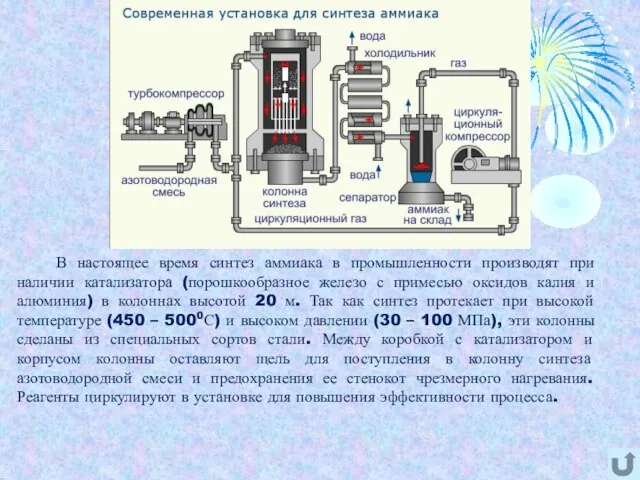
- 6. В настоящее время синтез аммиака в промышленности производят при наличии катализатора (порошкообразное железо с примесью оксидов
- 7. Разработав технологию получения аммиака прямым синтезом из азота и водорода, немецкие химики Фриц Габер и Карл
- 8. Установка для промышленного производства аммиака, разработанная Ф. Габером и К. Бошем. Массовое производство аммиака началось в
- 9. В период разработки промышленного способа синтеза аммиака проводились многочисленные исследования в поисках активных катализаторов. Были испытаны
- 10. Аммиак ядовит. ПДК = 20 мг/м3. Жидкий аммиак вызывает сильные ожоги. При содержании в воздухе 0,5%
- 11. Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков,
- 12. Отравление аммиаком вызывает также сильное возбуждение, вплоть до буйного бреда, а последствия могут быть весьма тяжелыми
- 13. Количество аварий, связанных с утечкой аммиака, по отношению к общему количеству систем, невелико. Все происшествия такого
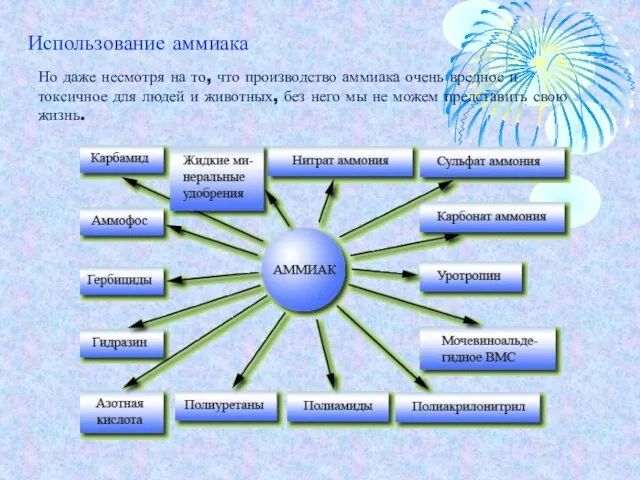
- 14. Но даже несмотря на то, что производство аммиака очень вредное и токсичное для людей и животных,
- 15. Использование аммиака
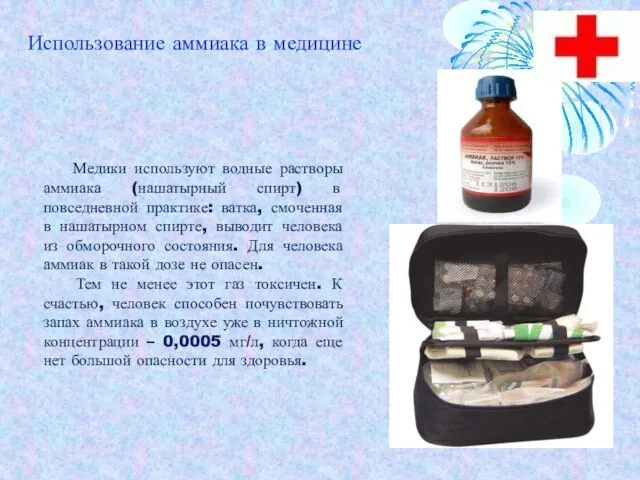
- 16. Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит
- 18. Скачать презентацию










 Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Галогены – химические элементы
Галогены – химические элементы Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Устный журнал из истории развития химии
Устный журнал из истории развития химии Общие химические свойства неметаллов
Общие химические свойства неметаллов Альдегиды, их химические и физические свойства. Получение и применение альдегидов
Альдегиды, их химические и физические свойства. Получение и применение альдегидов Строение электронных оболочек
Строение электронных оболочек G12 - класс антифризов
G12 - класс антифризов Амины. Классификация аминов
Амины. Классификация аминов Метаболизм липидов
Метаболизм липидов Моделирование деформаций углеродных слоёв при функционализации технического углерода
Моделирование деформаций углеродных слоёв при функционализации технического углерода Исследование реологических характеристик радиационносшитых водорастворимых полимеров с целью разработки новых составов для ГРП
Исследование реологических характеристик радиационносшитых водорастворимых полимеров с целью разработки новых составов для ГРП Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Сложные эфиры и жиры
Сложные эфиры и жиры Классификация химических реакций. 11 класс
Классификация химических реакций. 11 класс Материаловедение. Модуль
Материаловедение. Модуль Презентация на тему Подгруппа азота
Презентация на тему Подгруппа азота  Оксиды и основания
Оксиды и основания Химия неметаллов: углерод, кремний
Химия неметаллов: углерод, кремний Эксперимент с духами
Эксперимент с духами Ароматические и ненасыщенные альдегиды и кетоны
Ароматические и ненасыщенные альдегиды и кетоны Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме
Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме Химическая связь
Химическая связь Сырье, продукты, параметры гидроочистки
Сырье, продукты, параметры гидроочистки Кислоты в химии
Кислоты в химии Алкины
Алкины Презентация на тему Интересные факты из жизни Д. И. Менделеева
Презентация на тему Интересные факты из жизни Д. И. Менделеева  Магматические породы
Магматические породы