Содержание
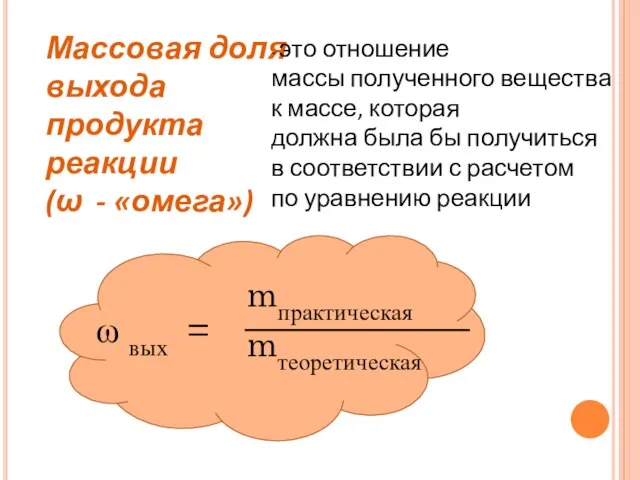
- 2. Массовая доля выхода продукта реакции (ω - «омега») - это отношение массы полученного вещества к массе,
- 3. Многие химические реакции не доходят до конца. При взаимодействии органических веществ часто образуются побочные продукты. При
- 4. Три типа задач с понятием «Выход продукта» 1. Даны массы исходного вещества и продукта реакции. Определить
- 5. 1) Прочитай внимательно условие задачи 2) Запиши: «Дано» и «Найти». 3) Составь уравнение реакции (не забудь
- 6. При действии алюминия на оксид цинка массой 32,4г получили 24 г цинка. Найдите массовую долю выхода
- 7. Дано: m(ZnO) = 32,4 г mпр(Zn) = 24 г Найти: ωвых(Zn) - ? Решение: 3. Составьте
- 8. Дано: Решение: m (ZnO) = 32,4 г 32,4 г ? m пр (Zn) = 24 г
- 9. Дано: Решение: m (ZnO) = 32,4 г 32,4 г ? m пр (Zn) = 24 г
- 10. 1) Прочитай внимательно условие задачи 2) Запиши: «Дано» и «Найти». 3) Составь уравнение реакции (не забудь
- 11. Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции
- 12. 3) Составь уравнение реакции (не забудь расставить коэффициенты). Дано: Решение: m (Al(OH)3)= 23,4 г ω вых
- 13. 4. Вычисли массу теоретическую продукта реакции Дано: m (Al(OH)3)= 23,4 г ω вых (Al2O3) = 92%
- 14. 5) Вычисли массу практическую продукта реакции, воспользовавшись обратной формулой (умножь массу теоретическую на долю выхода) Дано:
- 15. Алгоритм решения задач третьего типа (Определить массу исходного вещества) 1) Прочитай внимательно условие задачи. 2) Запиши:
- 16. 1. Внимательно прочитай условие задачи При действии оксида углерода (II) на оксид железа (III) получено железо
- 17. 3) Составь уравнение реакции (не забудь расставить коэффициенты). Дано: m пр (Fe) = 11,2 г ω
- 18. 4) Вычисли массу теоретическую продукта реакции, по обратной формуле (m пр / ω вых) . Дано:
- 20. Скачать презентацию
















 Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Химическая связь в молекулах. Экзаменационные вопросы
Химическая связь в молекулах. Экзаменационные вопросы Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Санитарно-гигиенические показатели питьевой воды
Санитарно-гигиенические показатели питьевой воды Полимеры
Полимеры Personal сare. Akypo Foam Rl 40
Personal сare. Akypo Foam Rl 40 Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Алкадиены: кумулированные, сопряженные, изолированные
Алкадиены: кумулированные, сопряженные, изолированные Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Презентация по химии. Спирты, их свойства и применение.
Презентация по химии. Спирты, их свойства и применение. Композитные материалы
Композитные материалы Свойства воды в твердом и жидком состоянии
Свойства воды в твердом и жидком состоянии Нуклеиновые кислоты (НК)
Нуклеиновые кислоты (НК) Ферментативная кинетика
Ферментативная кинетика Внеклассное мероприятие по химии для учащихся 8 классов
Внеклассное мероприятие по химии для учащихся 8 классов Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации Коррозия металлов
Коррозия металлов Reactivi444
Reactivi444 Трансжиры и их анализ
Трансжиры и их анализ Жаропрочные и жаростойкие стали
Жаропрочные и жаростойкие стали Средства декоративной косметики
Средства декоративной косметики Сахароза, крахмал, целлюлоза
Сахароза, крахмал, целлюлоза Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Реакции неполного окисления в органике
Реакции неполного окисления в органике Комплексные соединения
Комплексные соединения Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов
Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов Реакции ионного обмена. Задания. 9 класс
Реакции ионного обмена. Задания. 9 класс Окислительно-восстановительные реакции
Окислительно-восстановительные реакции