Содержание
- 2. Содержание 1.Определение 2.Номенклатура алкенов 3.Строение алкенов 4. Изомерия алкенов 5.Физические свойства 6.Химические свойства 7.Получение алкенов 8.Применение
- 3. Определение Алкены или олефины, или этиленовые углеводороды – непредельные углеводороды, в молекулах которых между атомами углерода
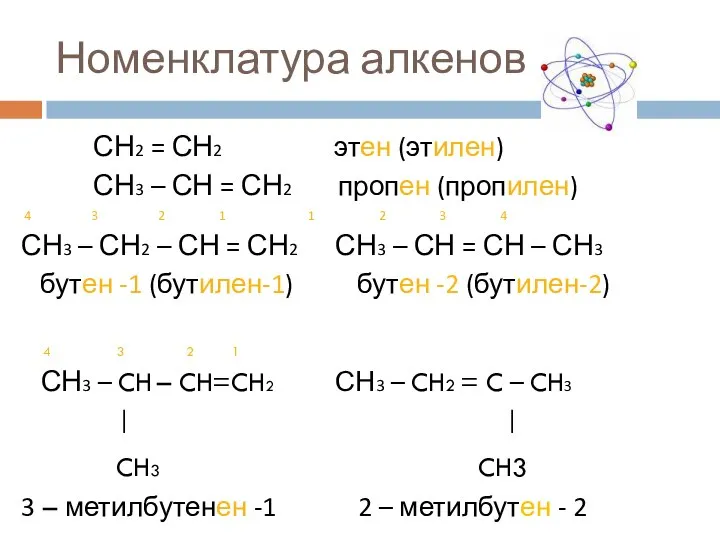
- 4. Номенклатура алкенов Название алкенов по систематической номенклатуре образуют из названий аналогично построенных алканов, заменяя суффиксы –ан
- 5. Номенклатура алкенов СН2 = СН2 этен (этилен) СН3 – СН = СН2 пропен (пропилен) 4 3
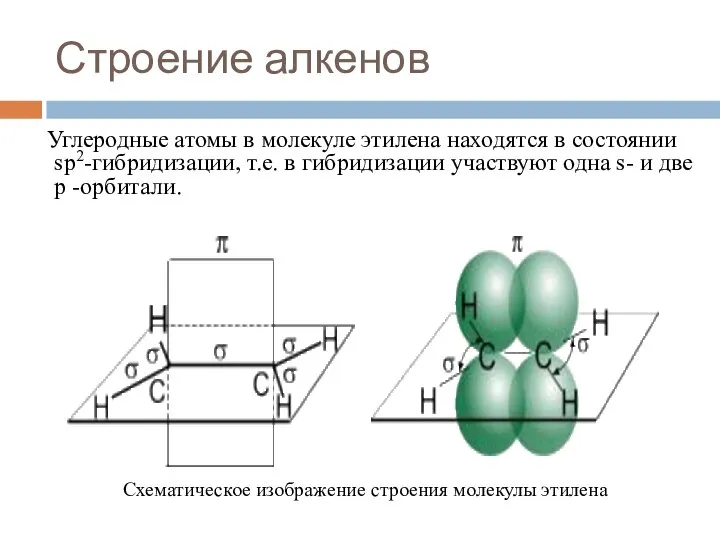
- 6. Строение алкенов Углеродные атомы в молекуле этилена находятся в состоянии sp2-гибридизации, т.е. в гибридизации участвуют одна
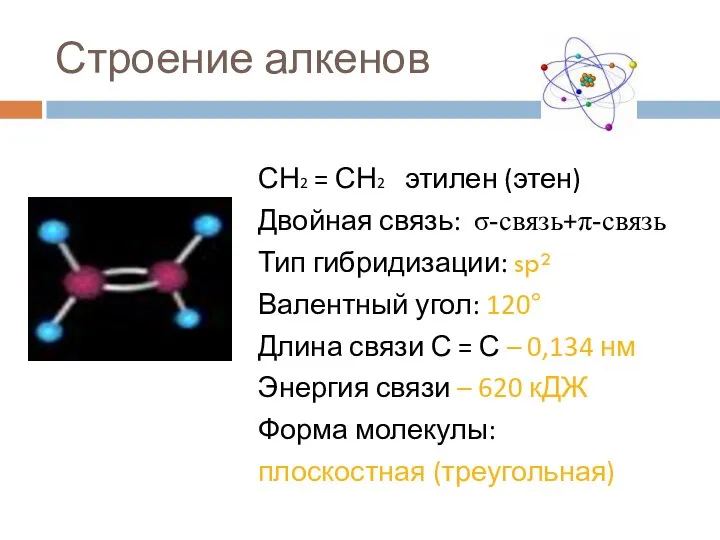
- 7. Строение алкенов СН2 = СН2 этилен (этен) Двойная связь: σ-связь+π-связь Тип гибридизации: sp² Валентный угол: 120°
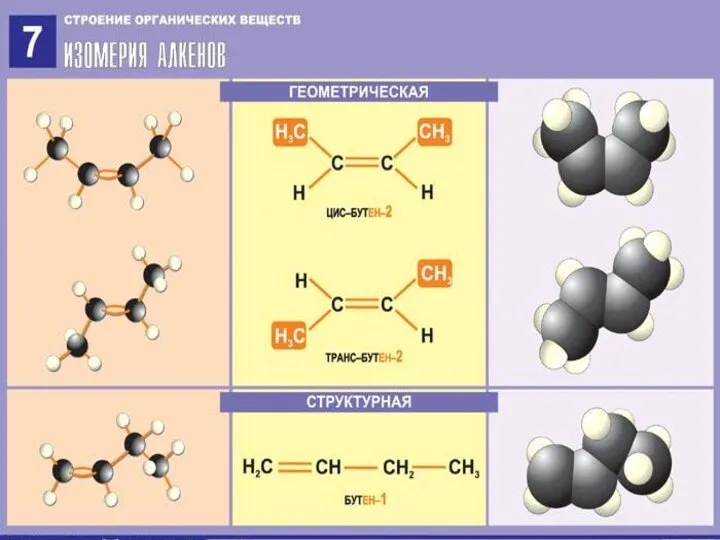
- 8. Изомерия алкенов Структурная изомерия 1) углеродного скелета CH2 = CH – CH2 – CH3 CH2 =
- 9. Изомерия алкенов Пространственная (геометрическая) CH3 H H H \ / \ / C = C C
- 10. Изомерия алкенов
- 11. Физические свойства По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C2–C4 –
- 12. Химические свойства I.Реакции присоединения: 1.Гидрирование : CH2=CH-CH3+Н2 → CH3-CH2-CH3 2.Галогенирование: CH2=CH-CH3+Br2 → CH2Br-CHBr -CH3 - обесцвечивание
- 13. Химические свойства 3.Гидрогалогенирование. Присоединение галогеноводородов к пропилену и другим несимметричным алкенам происходит в соответствии с правилом
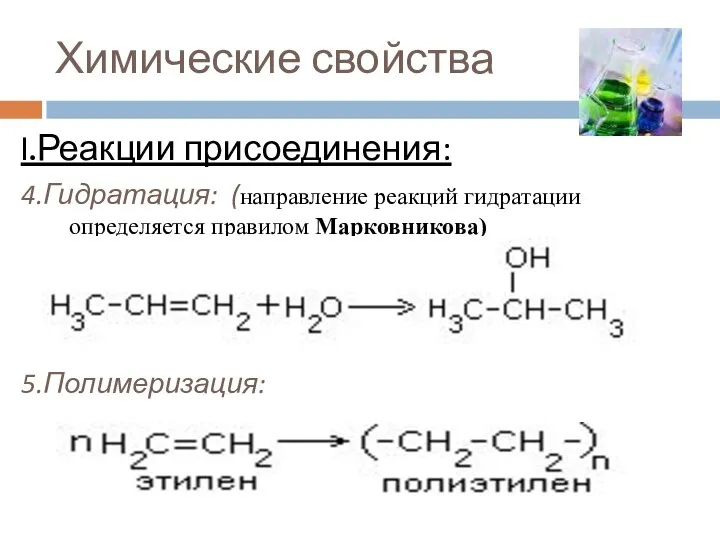
- 14. Химические свойства I.Реакции присоединения: 4.Гидратация: (направление реакций гидратации определяется правилом Марковникова) 5.Полимеризация:
- 15. Химические свойства II.Реакции окисления: 1.Полное окисление (горение): С2Н4 + 3О2 → 2СО2 + 2Н2О 2.Неполное окисление:
- 16. Химические свойства При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли (реакция Е.Е.Вагнера).
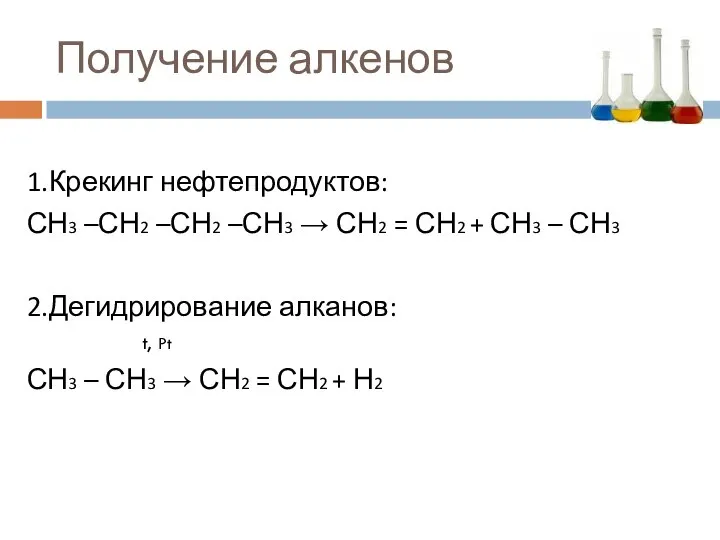
- 17. Получение алкенов 1.Крекинг нефтепродуктов: СН3 –СН2 –СН2 –СН3 → СН2 = СН2 + СН3 – СН3
- 18. Получение алкенов 3.Дегидратация спиртов: Порядок дегидратации вторичных и третичных спиртов определяется правилом А.М.Зайцева: при образовании воды
- 19. Получение алкенов (отщепление двух атомов галогена от соседних атомов углерода) при нагревании дигалогенидов с активными металлами)
- 20. Применение алкенов Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан,
- 21. Применение алкенов
- 23. Скачать презентацию














 Химия неорганическая и органическая
Химия неорганическая и органическая Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Буферные системы
Буферные системы Дисперсные системы
Дисперсные системы Синтетические волокна
Синтетические волокна Дорогие и дешёвые лекарства: Чем похожи и чем отличаются друг от друга?
Дорогие и дешёвые лекарства: Чем похожи и чем отличаются друг от друга? Показники нешкідливості води за хімічним складом
Показники нешкідливості води за хімічним складом Вода знакомая и не знакомая
Вода знакомая и не знакомая Альдегиды и кетоны
Альдегиды и кетоны Актуальные вопросы биохимии спорта. Лекция 2
Актуальные вопросы биохимии спорта. Лекция 2 Амины. Классификация аминов
Амины. Классификация аминов АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ
АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ Полезные ископаемые
Полезные ископаемые металлы
металлы Растворы и их концентрация. Массовая доля растворенного вещества
Растворы и их концентрация. Массовая доля растворенного вещества Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Электрохимия. Электролиты
Электрохимия. Электролиты proekt_TTU_3_1
proekt_TTU_3_1 Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Определение химической формулы металла по экспериментальным данным
Определение химической формулы металла по экспериментальным данным Уравнение состояния
Уравнение состояния Инертные газы и перспективы их применения
Инертные газы и перспективы их применения Вдоль по радуге
Вдоль по радуге Презентация на тему Химия и музыка 11 класс
Презентация на тему Химия и музыка 11 класс  Расчет псевдокритических свойств конденсатного газа и пластовых газоконденсатных жидкостей. Анализ рекомбинированных проб
Расчет псевдокритических свойств конденсатного газа и пластовых газоконденсатных жидкостей. Анализ рекомбинированных проб Соли
Соли Металлы общая характеристика
Металлы общая характеристика