Содержание
- 2. Реши задачу! Определите молекулярную формулу соединения содержащего углерода- 52,2% водорода -13% кислорода-34,8%
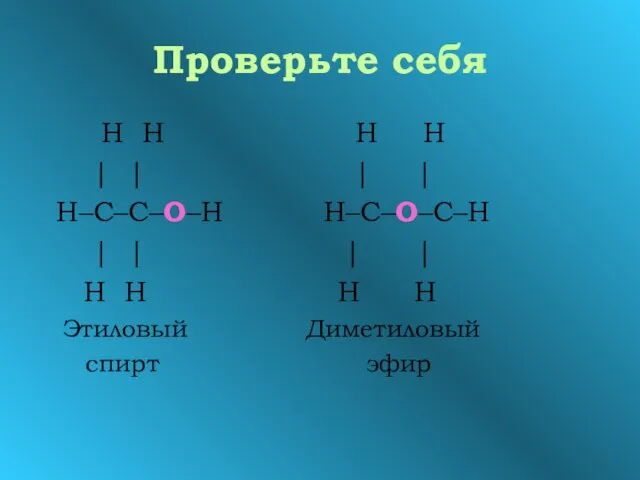
- 3. Проверьте себя С2Н6О
- 4. Задание: Составьте структурную формулу вещества состава С2Н6О Напоминание: валентность углерода IV, валентность водорода I , валентность
- 5. Проверьте себя Н Н Н Н | | | | Н–С–С–О–Н Н–С–О–С–Н | | | |
- 6. Взаимодействие спирта с активными металлами: Кислота + Ме → Соль + H2 2СН3–СН2–ОН + 2Na →
- 7. Вывод Группа -ОН влияет на химические свойства спиртов Спирты проявляют кислотные свойства (но слабее, чем у
- 8. Сравните температуры кипения веществ (ºС): СН3–СН2–ОН +78,3 СН3–О–СН3 - 23,7 СН3–СН3 - 88,6 Какое вещество при
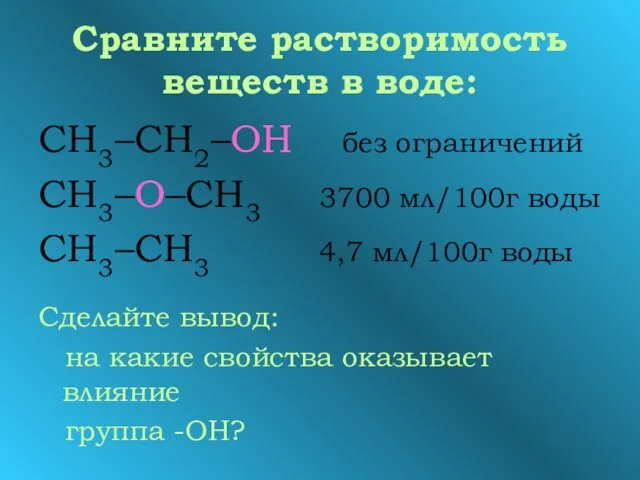
- 9. Сравните растворимость веществ в воде: СН3–СН2–ОН без ограничений СН3–О–СН3 3700 мл/100г воды СН3–СН3 4,7 мл/100г воды
- 10. Вывод Группа -ОН влияет на физические свойства спиртов Задание: Охарактеризуйте физические свойства этанола
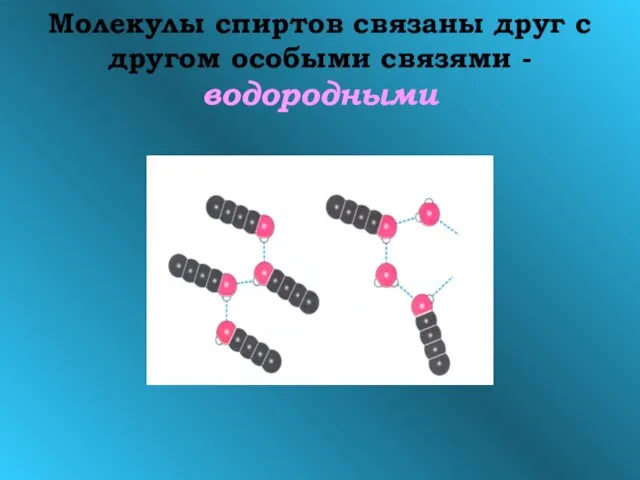
- 11. Молекулы спиртов связаны друг с другом особыми связями - водородными
- 12. Вывод Группа -ОН обусловливает свойства спиртов, поэтому данную группу атомов называют функциональной группой
- 13. Общая формула спиртов R–OH Радикал может быть предельным, непредельным и ароматическим; Функциональных групп может быть одна,
- 14. Предельные одноатомные спирты СnH2n+1OH Предельными одноатомными спиртами, или алканолами, называют органические соединения, в молекулах которых предельный
- 15. Задание: Составьте молекулярные и структурные формулы спиртов, содержащих в молекуле а) 1 атом углерода; б) 4
- 16. Сравните результат: а) СН3ОН – метанол (метиловый спирт) б) С4Н9ОН СН3–СН2–СН2–СН2–ОН бутанол-1 СН3–СН–СН2–СН3 бутанол-2 │ ОН
- 17. Изомерия предельных спиртов Изомерия углеродного скелета Изомерия положения функциональной группы Изомерия с гомологическим рядом простых эфиров
- 18. Химические свойства спиртов
- 19. Спирты окисляются Н О–Н │ │ СН3–С–ОН + [О] → СН3–С–ОН → │ │ Н Н
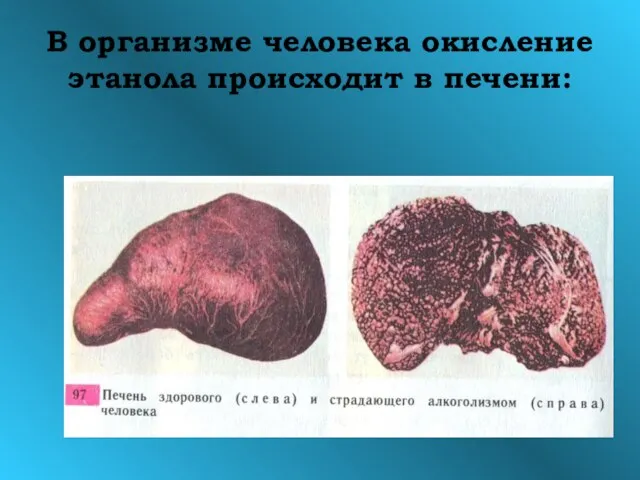
- 20. В организме человека окисление этанола происходит в печени:
- 21. Задание: составьте уравнение окисления пропанола-1 ?
- 22. Сравните результат: СН3–СН2–СН2–ОН + [О] → О → СН3–СН2–С + Н2О Н
- 23. Реакции отщепления (дегидратация спиртов) a) СН2–СН2 t, H2SO4 СН2=СН2 + Н2О │ │ H OH Внутримолекулярная
- 24. Реакции отщепления (дегидратация спиртов) ) СН3–СН2–OH + НО–СН2–СН3 t,H2SO4 → СН3–СН2–O–СН2–СН3 + Н2О Межмолекулярная дегидратация
- 25. Подобно углеводородам спирты горят с образованием углекислого газа и воды Закончите уравнения: а) СН3ОН + О2
- 26. Сравните результат: а) 2СН3ОН + 3О2 → 2СО2 + 4Н2О б) С2Н5ОН + 3О2→ 2СО2 +
- 27. Применение этанола
- 28. ЧЕЛАК Открытое акционерное общество Год создания: 1942 год Адрес: 454008 г. Челябинск, Свердловское шоссе, 1 Объем
- 29. В 1858 — 1859 годах русская интеллигенция проводила большую разъяснительную работу, да и сами крестьяне постепенно
- 30. Проверьте себя 1) Пропанол-1 и бутанол-1 - это а) изомеры; б) изоляторы; в) гомологи; г) геологи.
- 31. Проверьте себя 2) Процесс, уравнение которого СН3–СН2–ОН t, H2SO4 СН2=СН2 + Н2О является реакцией а) гидратации;
- 32. Проверьте себя 3) На рисунке изображен процесс: а) окисления спирта; б) межмолекулярной дегидратации; в) внутримолекулярной дегидратации;
- 33. Проверьте себя 4) Этанол может быть использован а) как средство, увеличивающее продолжительность жизни; б) в качестве
- 34. Проверьте себя 5) В медицине этиловый спирт используют для … а) лечения органов пищеварения; б) лечения
- 35. Похвалите себя, если ….: ) Пропанол-1 и бутанол-1- это (в) гомологи 2) СН3–СН2–ОН t, H2SO4 СН2=СН2
- 36. Теперь вы знаете: Какие вещества относят к спиртам; Классификацию спиртов; У предельных одноатомных спиртов знаете: Номенклатуру
- 37. Жертвы алкогольной зависимости… Иосиф Бродский Уинстон Черчилль
- 38. Владимир Высоцкий Жертвы алкогольной зависимости… Сергей Есенин
- 39. Александр Блок Джек Лондон Жертвы алкогольной зависимости…
- 40. Береги себя...
- 42. Скачать презентацию














![Спирты окисляются Н О–Н │ │ СН3–С–ОН + [О] → СН3–С–ОН →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291136/slide-18.jpg)

![Сравните результат: СН3–СН2–СН2–ОН + [О] → О → СН3–СН2–С + Н2О Н](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291136/slide-21.jpg)


















 Валентность
Валентность Аналитическая химия. Введение
Аналитическая химия. Введение Молекулярная струйная печать
Молекулярная струйная печать gidroliz_soley (1)
gidroliz_soley (1) Калифорний Cf
Калифорний Cf Железо
Железо Металлы
Металлы Круговорот азота
Круговорот азота Жиры. Классификация
Жиры. Классификация Получение и химические свойства металлов
Получение и химические свойства металлов Оксиды. Классификация оксидов
Оксиды. Классификация оксидов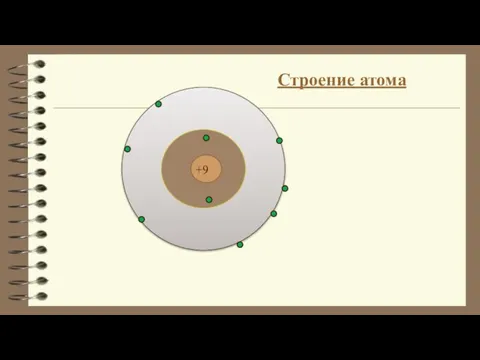 Строение атома
Строение атома Нефть
Нефть Квантовая химия
Квантовая химия Явление когда один элемент образует несколько простых веществ - аллотропия
Явление когда один элемент образует несколько простых веществ - аллотропия Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Классификация реакций
Классификация реакций Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Особенности строения вещества. Лекция №2. Строение кристаллов
Особенности строения вещества. Лекция №2. Строение кристаллов Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Хром. Месторождения
Хром. Месторождения Получение аминов
Получение аминов Классификация неорганических соединений
Классификация неорганических соединений Новое в ЕГЭ. Химия
Новое в ЕГЭ. Химия Получение этилового спирта из древесины
Получение этилового спирта из древесины Металлы. Физические свойства металлов
Металлы. Физические свойства металлов