Содержание
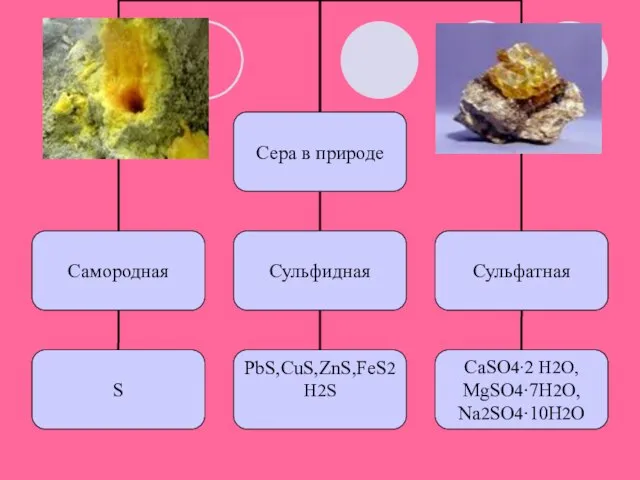
- 2. Сера известна человечеству с древних времен, т. к. она в природе встречается в самородном виде. Считалось,
- 3. Сернистый газ использовали для отбеливания тканей. При раскопках Помпеи нашли картину, на которой изображен противень с
- 4. Кроме того, серу и ее соединения использовали для приготовления косметических средств и для лечения кожных заболеваний..
- 5. Ее применяли для военных целей. Так в 670 г защитники Константинополя сожгли арабский флот с помощью
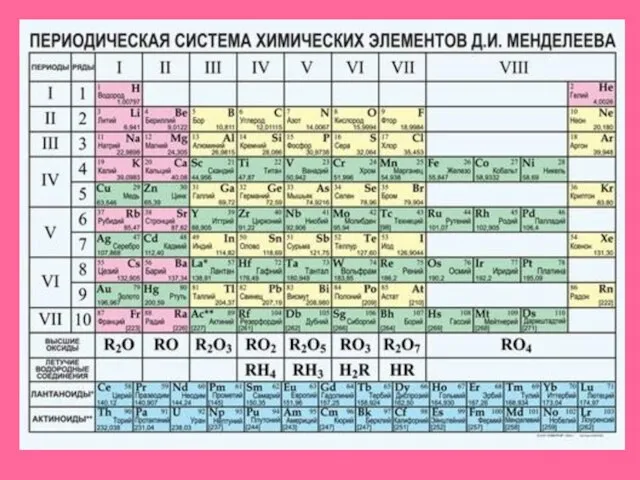
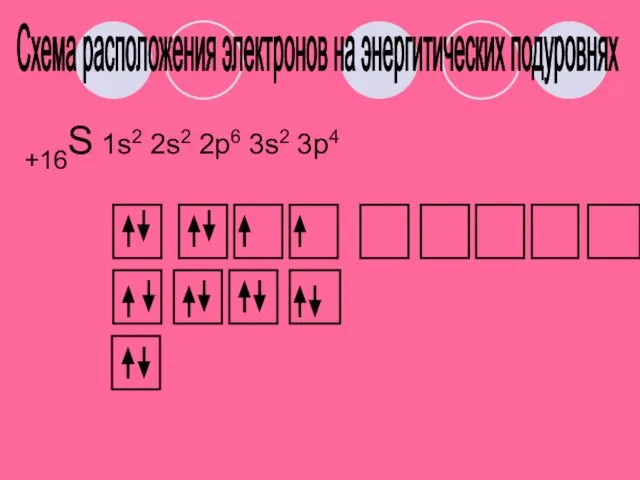
- 7. +16S а) находится в Vl группе, главной подгруппе б) lll период. 3 ряд в) неметалл г)
- 8. +16S 1s2 2s2 2p6 3s2 3p4 Схема расположения электронов на энергитических подуровнях
- 9. S8-молекула серы состоит из 8-и атомов связь в молекуле - ковалентная неполярная молекула неполярная кристаллическая решётка
- 11. а) Самородную серу очищают от примесей песка и глины. Для этого ее расплавляют перегретым водяным паром,
- 12. Сера имеет несколько аллотропных модификаций. Наиболее устойчивы ромбическая и моноклинная. Это кристаллические вещества, которые различаются формой
- 13. Кристаллы состоят из молекул S8( кр. решетка молекулярная –неполярная) ромбическая сера имеет цвет лимонно-желтый, tпл.=112,8C, моноклинная
- 14. При быстром охлаждении расплавлено серый образуется ещё одна неустойчивая аллотропная модификация- пластическая сера Sn , которая
- 16. Большая часть серы используется для производства серной кислоты. Значительное количество серы расходуется для вулканизации каучука (она
- 17. Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип =
- 18. Сера реагирует со щелочными металлами без нагревания: 2Na + S ® Na2S c остальными металлами (кроме
- 19. Восстановительные свойства сера проявляет в реакциях с сильными окислителями: c кислородом: S + O2 –t°® S+4O2
- 21. Скачать презентацию















 Химические реакции
Химические реакции Классы неорганических соединений
Классы неорганических соединений Кристаллогидраты
Кристаллогидраты Конкурс юных химиков
Конкурс юных химиков Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Электрический ток в металлах
Электрический ток в металлах Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение
Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение Ķīmiskais līdzsvars un faktori, kas to ietekmē
Ķīmiskais līdzsvars un faktori, kas to ietekmē Неметаллы в природе и жизни человека
Неметаллы в природе и жизни человека Презентация на тему Удобрения и их классификация
Презентация на тему Удобрения и их классификация  Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами
Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами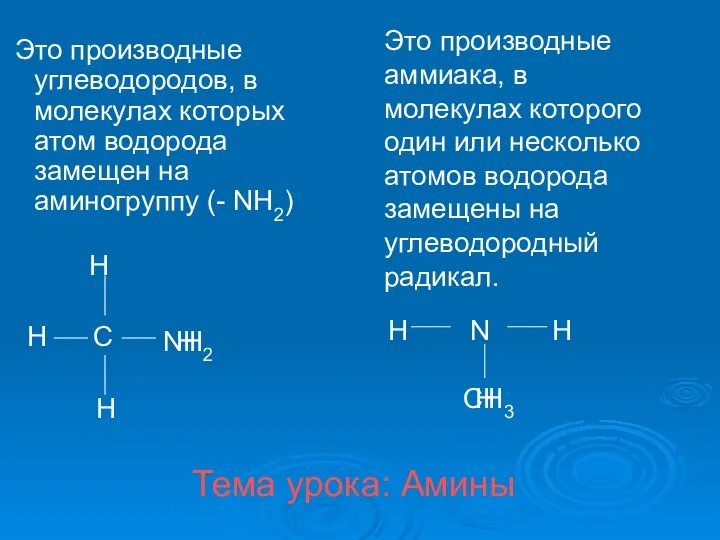 Амины. Классификация аминов
Амины. Классификация аминов Коррозия металлов и борьба с ней. Лабораторная работа
Коррозия металлов и борьба с ней. Лабораторная работа Dereglarea metabolismului
Dereglarea metabolismului Презентация на тему Обратимость химических реакций. Химическое равновесие
Презентация на тему Обратимость химических реакций. Химическое равновесие  Соль и ее свойства. Добыча соли
Соль и ее свойства. Добыча соли Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества
Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества Свойства воды
Свойства воды Протравка стекла с помощью ионного обмена
Протравка стекла с помощью ионного обмена Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы Витамины. (10 класс)
Витамины. (10 класс) Состав и свойства нефти
Состав и свойства нефти Соединения железа в природе
Соединения железа в природе 9 кл Урок 7 Розчинність речовин
9 кл Урок 7 Розчинність речовин Химическая связь и строение вещества
Химическая связь и строение вещества Атомистическое моделирование
Атомистическое моделирование Физическая химия
Физическая химия