Содержание
- 2. Учебная цель: изучить способы получения, химические свойства и применение алкенов на примере непредельного углеводорода - этилена
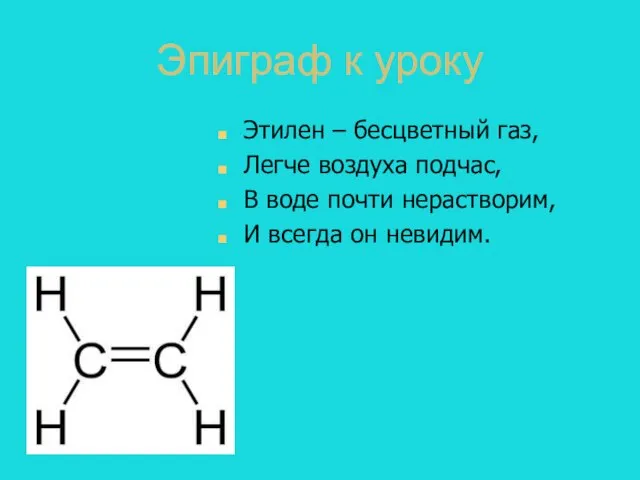
- 3. Эпиграф к уроку Этилен – бесцветный газ, Легче воздуха подчас, В воде почти нерастворим, И всегда
- 4. Ответьте, пожалуйста, на следующие вопросы: Какие углеводороды называются алкенами? Какова общая формула алкенов? Какова структурная формула
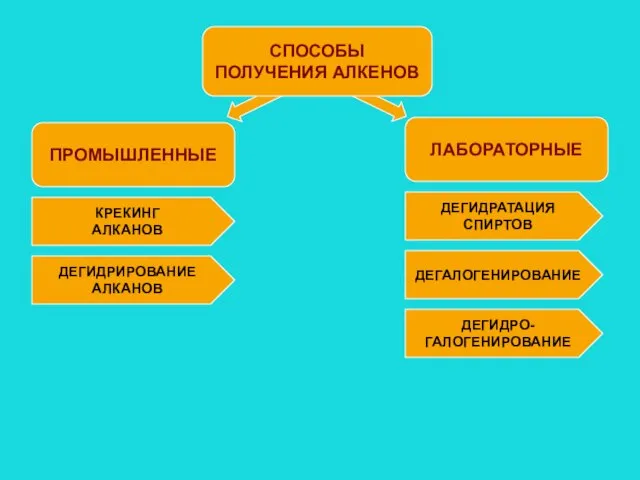
- 5. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИРОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ
- 6. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ КРЕКИНГ АЛКАНОВ АЛКАН → АЛКАН + АЛКЕН С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИНОЙ
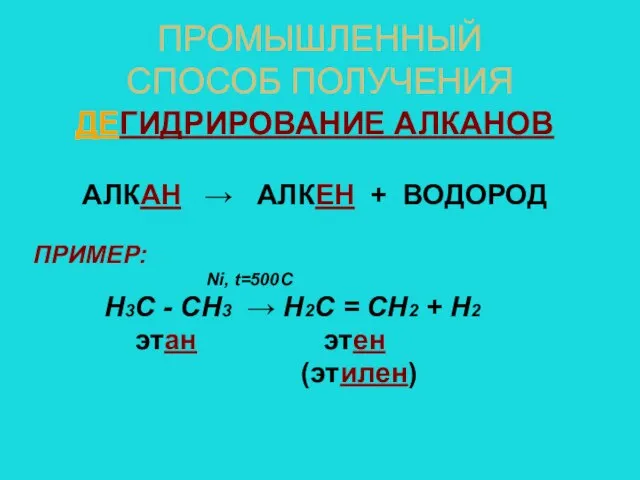
- 7. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД ПРИМЕР: Ni, t=500C Н3С - СН3
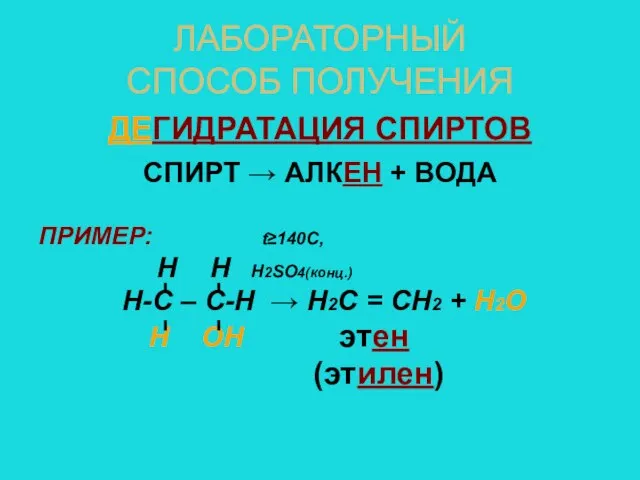
- 8. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥140C, Н Н Н2SO4(конц.) Н-С
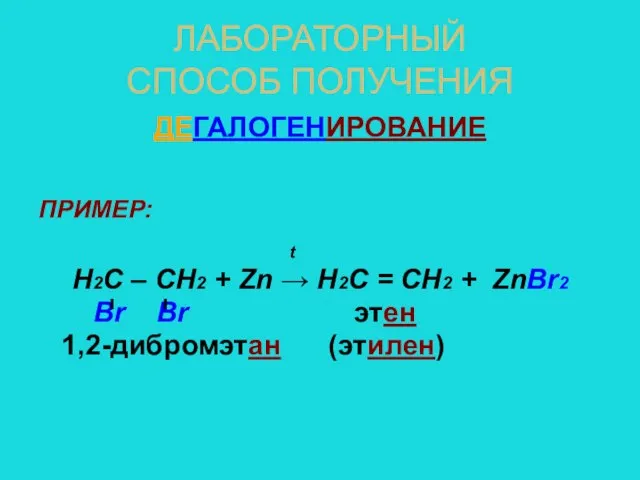
- 9. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГАЛОГЕНИРОВАНИЕ ПРИМЕР: t Н2С – СН2 + Zn → Н2С = СН2 +
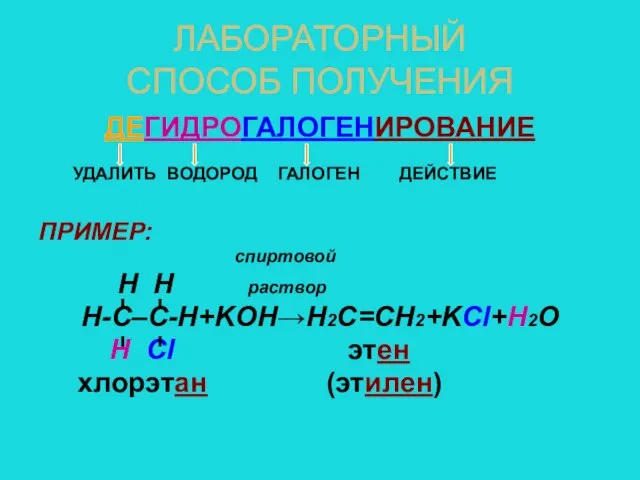
- 10. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: спиртовой H H раствор Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O Н Cl
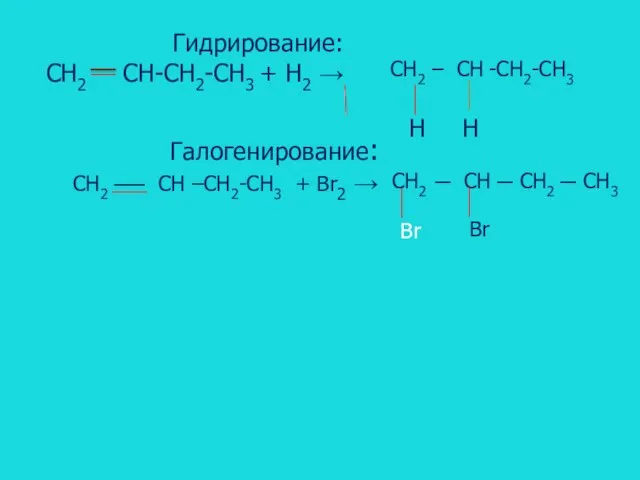
- 11. Гидрирование: CH2 CH-CH2-CH3 + H2 → CH2 – CH -CH2-CH3 Галогенирование: CH2 ── CH –CH2-CH3 +
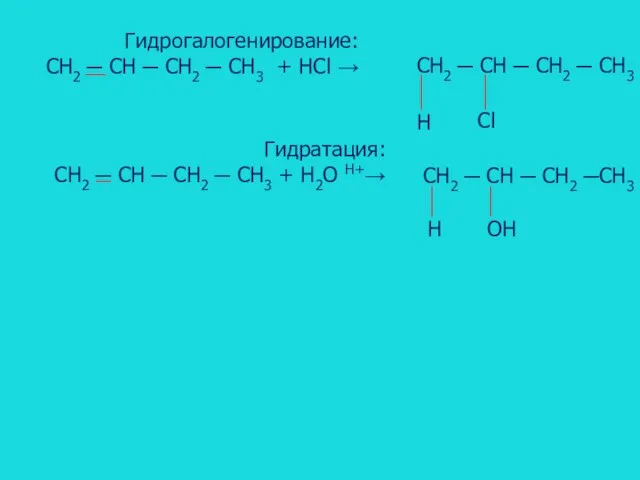
- 12. Гидрогалогенирование: CH2 ─ CH ─ CH2 ─ CH3 + HCl → CH2 ─ CH ─ CH2
- 13. РЕАКЦИИ ОКИСЛЕНИЯ ГОРЕНИЕ АЛКЕНОВ ПРИМЕР: С2Н4 + 3О2 2СО2 + 2Н2О
- 14. РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ (реакция Е.Е.Вагнера) Н2С=СН2 + [O] +
- 15. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Это процесс соединения одинаковых молекул в более крупные. ПРИМЕР: n CH2=CH2 (-CH2-CH2-)n этилен полиэтилен
- 16. Применение этилена
- 18. СИНКВЕЙН 1 строка – имя существительное (тема синквейна) 2 строка – два прилагательных (раскрывающие тему синквейна)
- 19. Этилен Ненасыщенный, активный Горит, обесцвечивает, присоединяет Этилен – представитель непредельных углеводородов Алкен
- 20. ДОМАШНЕЕ ЗАДАНИЕ Параграф 4, № 8,9 По желанию: Составить цепочку превращений, используя материал по темам «Алканы»
- 22. Скачать презентацию











 Классификация химических элементов
Классификация химических элементов Vvedenie_v_khimiyu
Vvedenie_v_khimiyu Радиоактивные изотопы
Радиоактивные изотопы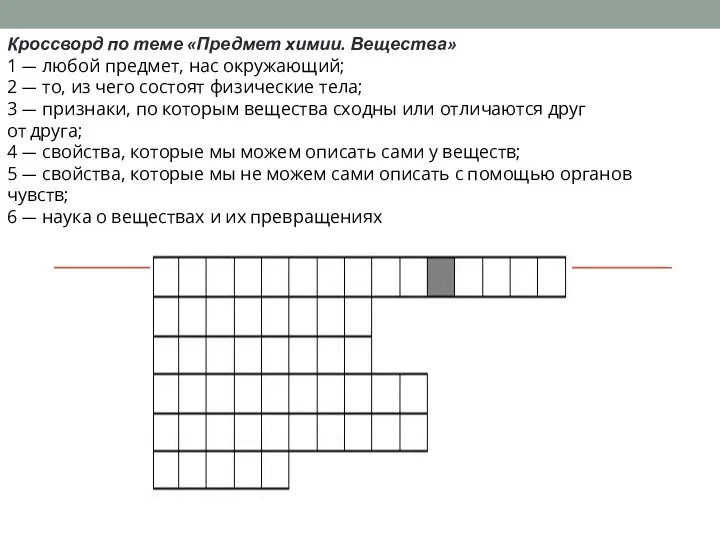 Предмет химии. Вещества
Предмет химии. Вещества Циклоалканы (циклопарафины)
Циклоалканы (циклопарафины)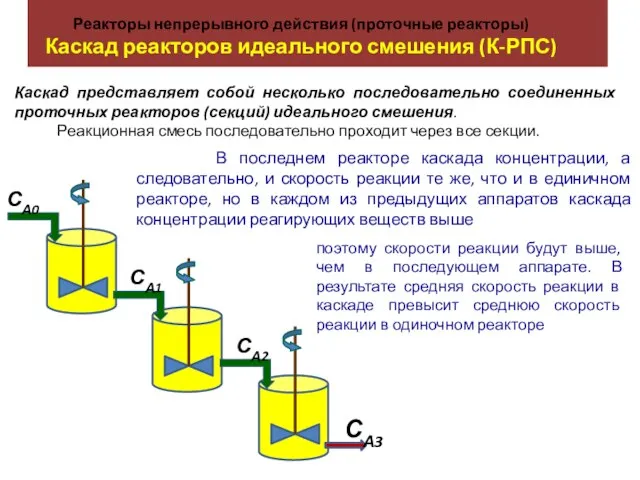 Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС)
Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС) Практикум по химии и технологии нефти и газа
Практикум по химии и технологии нефти и газа Изомерия
Изомерия Французский физик, химик, металловед 1850 - 1936
Французский физик, химик, металловед 1850 - 1936 Конструкционные и функциональные материалы: конструкционные материалы. Введение
Конструкционные и функциональные материалы: конструкционные материалы. Введение Строение атома
Строение атома Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М
Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М Строение атома. Распределение электронов
Строение атома. Распределение электронов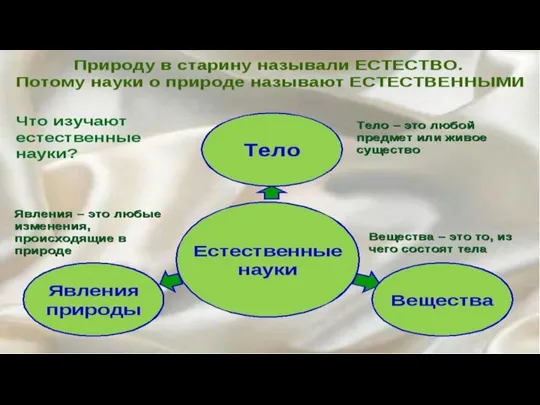 Вещество. Простые и сложные вещества
Вещество. Простые и сложные вещества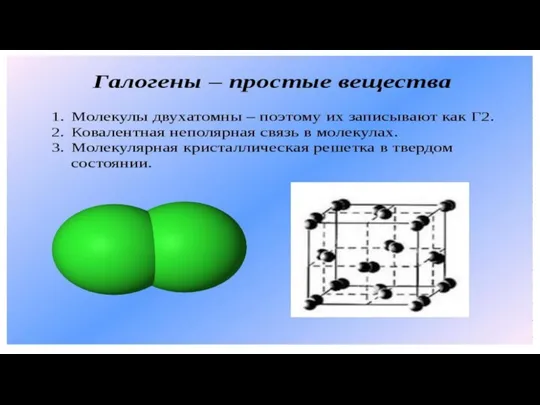 Галогены - простые вещества
Галогены - простые вещества Растворы полимеров
Растворы полимеров Уксусная кислота
Уксусная кислота Фарфор и фаянс
Фарфор и фаянс Железо и его соединения
Железо и его соединения Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10
Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10 Молярный объем газов
Молярный объем газов Полимеры
Полимеры Основы материаловедения. Раздел 1
Основы материаловедения. Раздел 1 Алкадиены. Каучук. История открытия каучука
Алкадиены. Каучук. История открытия каучука Обобщение и подготовка к химии 8 класс
Обобщение и подготовка к химии 8 класс Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Свойства веществ
Свойства веществ Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты
Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты