Содержание
- 2. Состав Кислоты - это сложные вещества, в молекулах которых содержат атомы водорода и кислотный остаток H-R,
- 3. Классификация кислот Одноосновные кислоты, например, HCl, HNO3 (отщепляют при диссоциации один атом водорода) Многоосновные кислоты, например,
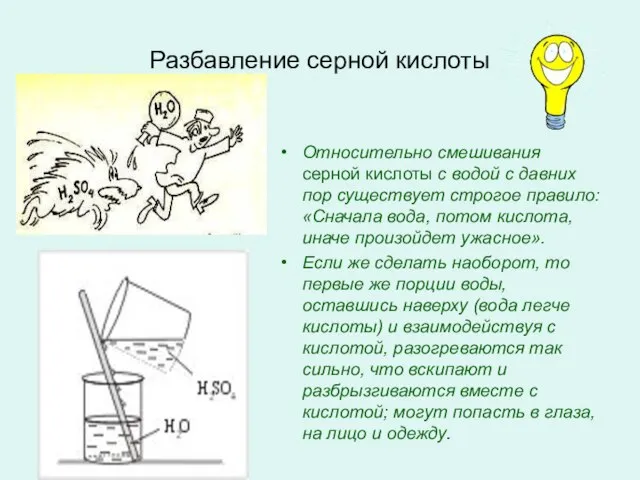
- 4. Разбавление серной кислоты Относительно смешивания серной кислоты с водой с давних пор существует строгое правило: «Сначала
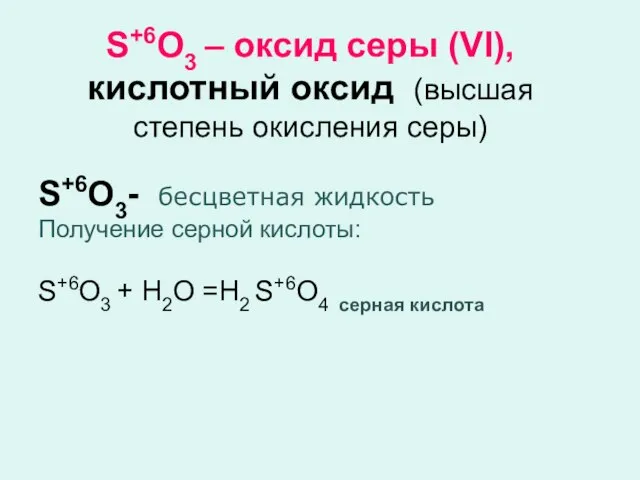
- 5. S+6O3 – оксид серы (VI), кислотный оксид (высшая степень окисления серы) S+6O3- бесцветная жидкость Получение серной
- 6. Химические свойства серной кислоты разбавленная серная кислота проявляет все характерные свойства кислот: С оксидами металлов.(реакция обмена)
- 7. Качественная реакция на ион –SO42- Реактивом на серную кислоту и ее соли является катион бария ,
- 8. Концентрированная серная кислота Ме+Н2SO4(кoнц)→МеSO4+H2O+(Н2S,S,SO2) Серная кислота(конц) восстанавливается до (Н2S,S,SO2) в зависимости от активности металла и условий
- 9. Применение серной кислоты.
- 10. Сульфат натрия.
- 11. Сульфат никеля
- 12. Сульфат меди дать классификацию химическим реакциям.
- 14. Скачать презентацию








 Plexiglas. Органическое стекло
Plexiglas. Органическое стекло Простые и сложные вещества (8 класс)
Простые и сложные вещества (8 класс) Лекция 3. Строение электронной оболочки атома (1)
Лекция 3. Строение электронной оболочки атома (1) Алюминий и его сплавы, их характеристика. Деформируемые сплавы алюминия. Деформируемые и литейные сплавы алюминия
Алюминий и его сплавы, их характеристика. Деформируемые сплавы алюминия. Деформируемые и литейные сплавы алюминия Амфотерность. Амфотерные соединения
Амфотерность. Амфотерные соединения Классификация сложных неорганических веществ. Оксиды
Классификация сложных неорганических веществ. Оксиды Применение эфиров в производстве автомобильных бензинов
Применение эфиров в производстве автомобильных бензинов Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Определение химического эквивалента, эквивалентной и атомной массы металла
Определение химического эквивалента, эквивалентной и атомной массы металла Презентация на тему Закон постоянства состава
Презентация на тему Закон постоянства состава  Типы химических реакций. 8 класс
Типы химических реакций. 8 класс Презентация на тему Азотная кислота
Презентация на тему Азотная кислота  Презентация на тему Фуллерены и нанотрубки
Презентация на тему Фуллерены и нанотрубки  Этанол. Химические свойства этанола
Этанол. Химические свойства этанола Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Менделеев Дмитрий Иванович
Менделеев Дмитрий Иванович Ca КАЛЬЦИЙ
Ca КАЛЬЦИЙ Перспективы использования микроволнового излучения в органической химии
Перспективы использования микроволнового излучения в органической химии Стехиометрические законы химии
Стехиометрические законы химии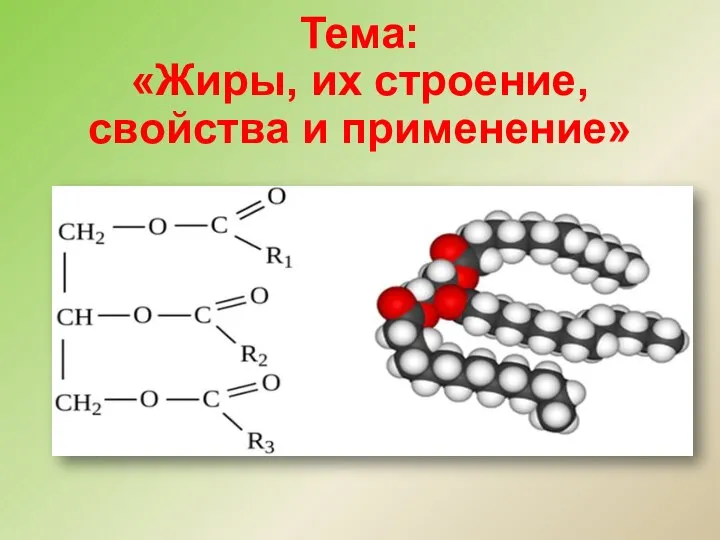 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Нуклеиновые кислоты
Нуклеиновые кислоты Водород – первый элемент в периодической таблице
Водород – первый элемент в периодической таблице Массовая доля химич элемента
Массовая доля химич элемента Физико-химические свойства растворов ВМС
Физико-химические свойства растворов ВМС Химические свойства оснований
Химические свойства оснований Презентация на тему Основные классы неорганических соединений
Презентация на тему Основные классы неорганических соединений  Ковалентная связь
Ковалентная связь