Содержание
- 2. ИСТОРИЯ В чистом виде металл был получен в 1808 г. Джоном. Когда Шееле в 1774 г.
- 3. ХИМИЧЕСКИЕ СВОЙСТВА При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде Mn + O2 =
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА марганец - серебристо-белый твёрдый хрупкий металл. Известны четыре кристаллические модификации марганца, каждая из которых
- 5. ПОЛУЧЕНИЕ ОКСИДА МАРГАНЦА Марганец один из распространенных элементов в природе, (14 место). Основной минерал - пиролюзит,
- 7. Скачать презентацию
Слайд 2ИСТОРИЯ
В чистом виде металл был получен в 1808 г. Джоном. Когда
ИСТОРИЯ
В чистом виде металл был получен в 1808 г. Джоном. Когда

Шееле в 1774 г. занимался исследованием пиролюзита, он посылал своему другу Юхану Готлибу Гану образцы этого минерала. Ган, впоследствии профессор, выдающийся химик своего времени, скатывал из пиролюзита шарики, добавляя к руде масло, и сильно нагревал их в тигле, выложенном древесным углем. Получались металлические шарики, весившие втрое меньше, чем шарики из руды. Это и был марганец. Новый металл называли сначала "магнезия", но так как в то время уже была известна белая магнезия - окись магния, металл переименовали в "магнезиум"; это название и было принято Французской комиссией по номенклатуре в 1787 г.
Но в 1808 г. Хэмфри Дэви открыл магний и тоже назвал его "магнезиум", тогда во избежание путаницы марганец стали называть "манганум."
Но в 1808 г. Хэмфри Дэви открыл магний и тоже назвал его "магнезиум", тогда во избежание путаницы марганец стали называть "манганум."
Слайд 3ХИМИЧЕСКИЕ СВОЙСТВА
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде
ХИМИЧЕСКИЕ СВОЙСТВА
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде

Mn + O2 = MnO2.
Марганец при нагревании разлагает воду, вытесняя водород: Mn + 2H2O = Mn(OH)2 + H2.
C соляной и серной кислотами реагирует по уравнению: Mn + 2H+ = Mn2+ + H2
С концентрированной серной кислотой реакция идёт по уравнению: Mn + 2H2SO4 = MnSO4 + SO2 + 2H2O
С разбавленой азотной кислотой: 3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O
Расплавленный марганец реагирует с углеродом, образуя карбиды Mn3C и другие. Марганец образует также силициды, бориды, фосфиды.
Марганец при нагревании разлагает воду, вытесняя водород: Mn + 2H2O = Mn(OH)2 + H2.
C соляной и серной кислотами реагирует по уравнению: Mn + 2H+ = Mn2+ + H2
С концентрированной серной кислотой реакция идёт по уравнению: Mn + 2H2SO4 = MnSO4 + SO2 + 2H2O
С разбавленой азотной кислотой: 3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O
Расплавленный марганец реагирует с углеродом, образуя карбиды Mn3C и другие. Марганец образует также силициды, бориды, фосфиды.
Слайд 4ФИЗИЧЕСКИЕ СВОЙСТВА
марганец - серебристо-белый твёрдый хрупкий металл. Известны четыре кристаллические модификации
ФИЗИЧЕСКИЕ СВОЙСТВА
марганец - серебристо-белый твёрдый хрупкий металл. Известны четыре кристаллические модификации

марганца, каждая из которых термодинамически устойчива в определённом интервале температур. Ниже 707°С устойчив a-марганец, имеющий сложную структуру - в его элементарную ячейку входят 58 атомов. Сложность структуры марганца при температурах ниже 707°С обусловливает его хрупкость.
Слайд 5ПОЛУЧЕНИЕ ОКСИДА МАРГАНЦА
Марганец один из распространенных элементов в природе, (14 место).
ПОЛУЧЕНИЕ ОКСИДА МАРГАНЦА
Марганец один из распространенных элементов в природе, (14 место).
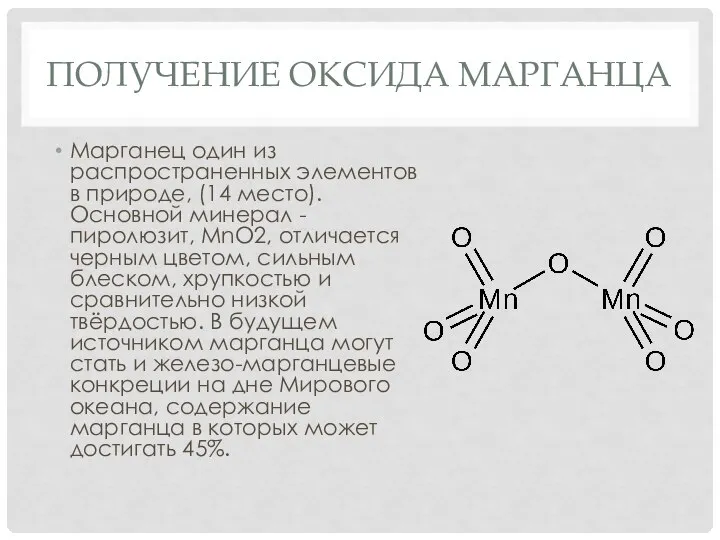
Основной минерал - пиролюзит, MnO2, отличается черным цветом, сильным блеском, хрупкостью и сравнительно низкой твёрдостью. В будущем источником марганца могут стать и железо-марганцевые конкреции на дне Мирового океана, содержание марганца в которых может достигать 45%.
- Предыдущая
Ядовитые растения Презентация на тему Элементы таблицы Менделеева
Презентация на тему Элементы таблицы Менделеева  Индиго-краситель
Индиго-краситель Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 1 Класифікація_Завада_лекция 1_укр_2018(1)
1 Класифікація_Завада_лекция 1_укр_2018(1) Дизельное топливо
Дизельное топливо Материальный и тепловой балансы абсорбции
Материальный и тепловой балансы абсорбции Массовая доля химического элемента
Массовая доля химического элемента Исследование зависимости интенсивности люминесценции пленок оксида цинка от уровня фотовозбуждения
Исследование зависимости интенсивности люминесценции пленок оксида цинка от уровня фотовозбуждения Неорганические окислители и восстановители
Неорганические окислители и восстановители Углеводы. Тема 9
Углеводы. Тема 9 Потенциометрические анализаторы Поверка рН - метра
Потенциометрические анализаторы Поверка рН - метра Исследование биодеградации полимерных материалов методом АСМ
Исследование биодеградации полимерных материалов методом АСМ Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Сера и ее соединения
Сера и ее соединения Дисперсные системы
Дисперсные системы Сложные вещества оксиды
Сложные вещества оксиды Презентация на тему Неорганічні речовини живих організмів
Презентация на тему Неорганічні речовини живих організмів  Типы химических связей
Типы химических связей Гидроксиды металлов
Гидроксиды металлов Металлы и их соединения. Решение экспериментальных задач
Металлы и их соединения. Решение экспериментальных задач Селективность (реакторы)
Селективность (реакторы) Презентация на тему Щавелевая кислота
Презентация на тему Щавелевая кислота  Кислоты, их состав и название
Кислоты, их состав и название Презентация по Химии "Токсическое действие неорганических веществ"
Презентация по Химии "Токсическое действие неорганических веществ"  Удивительная соль
Удивительная соль Кинетика кристаллизации сплавов
Кинетика кристаллизации сплавов 676a1c5e85f2455c9a6d495b8a94b9f9
676a1c5e85f2455c9a6d495b8a94b9f9 Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки
Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки