Содержание
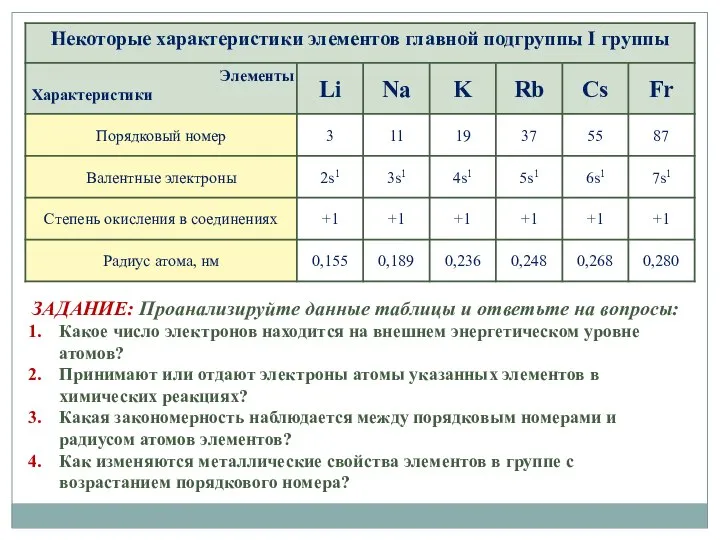
- 2. ЗАДАНИЕ: Проанализируйте данные таблицы и ответьте на вопросы: Какое число электронов находится на внешнем энергетическом уровне
- 3. Li Na K Rb Cs Fr На внешнем энергетическом уровне 1 электрон → легко отдают единственный
- 4. Нет реальных фото, т.к. максимальные массы образцов 10-7г Простые вещества образованы металлической химической связью и имеют
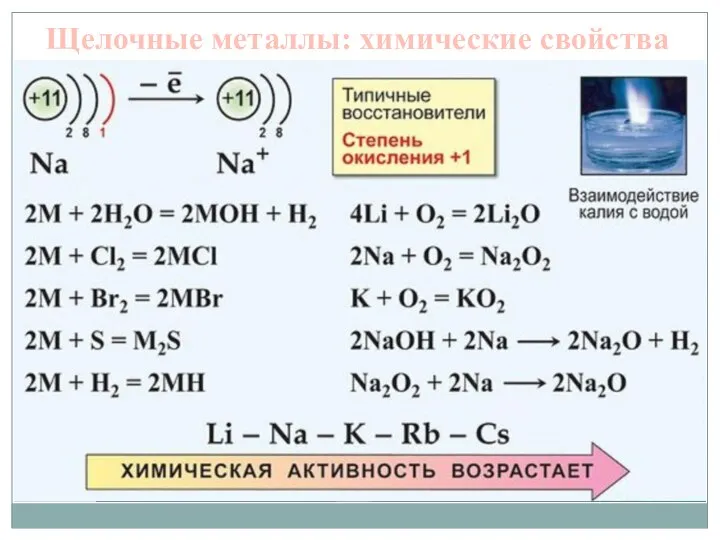
- 5. Щелочные металлы: химические свойства В реакциях с кислородом щелочные металлы ведут себя индивидуально, образуя разные соединения.
- 6. Взаимодействие с водой у лития, натрия и калия приводит к образованию растворимых оснований – щелочей (название
- 7. Щелочные металлы: химические свойства
- 8. Так как соединения щелочных металлов хорошо растворимы в воде (не образуют осадки), для их качественного определения
- 9. В природе щелочные металлы встречаются только в виде соединений (как вы думаете, почему?) Наиболее распространены соединения
- 10. Оксиды и пероксиды щелочных металлов Имеют основный характер, взаимодействуют с водой и образуют щелочи, могут реагировать
- 11. Имеют основный характер – основания, растворимые в воде (щелочи), могут реагировать с кислотами, кислотными оксидами, солями
- 13. Скачать презентацию








 Типы химических реакций
Типы химических реакций Вода и ее свойства
Вода и ее свойства Железо и его соединения
Железо и его соединения Гордость земли Большемурашкинской: Владимир Васильевич Марковников
Гордость земли Большемурашкинской: Владимир Васильевич Марковников Классификация химических реакций
Классификация химических реакций Водородная химическая связь
Водородная химическая связь Характеристика щелочных металлов (9 класс)
Характеристика щелочных металлов (9 класс) Воздействие слюны на крахмал
Воздействие слюны на крахмал Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Теория электролитической диссоциации
Теория электролитической диссоциации Соединения серы. Сернистая и серная кислоты
Соединения серы. Сернистая и серная кислоты 1_
1_ Химические свойства алкенов. Получение
Химические свойства алкенов. Получение Предельные углеводороды (циклоалканы)
Предельные углеводороды (циклоалканы) Соли: получение
Соли: получение Презентация на тему Строение атома Химическая связь
Презентация на тему Строение атома Химическая связь  Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Органическая химия. Получение альдегидов и кетонов
Органическая химия. Получение альдегидов и кетонов Характеристика элемента по положению в таблице Д.И.Менделеева
Характеристика элемента по положению в таблице Д.И.Менделеева Оксиды
Оксиды 1.2. Измерения веществ
1.2. Измерения веществ Алканы (строение и изомерия)
Алканы (строение и изомерия) Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Презентация на тему ОВР в органической химии
Презентация на тему ОВР в органической химии  Практика по химии
Практика по химии Химия и производство
Химия и производство Азотная кислота
Азотная кислота Слюда. История открытия
Слюда. История открытия