Содержание
- 2. 1825 год. Майкл Фарадей выделил бензол из светильного газа.
- 3. 1833 год Фридрих Вёлер и Юстус Либих выделили бензойную кислоту из бензойной смолы.
- 4. 1833 год Эйльхард Мичерлих получил бензол из бензойной кислоты
- 5. 1865 год Фридрих-Август Кекуле открыл структуру бензола
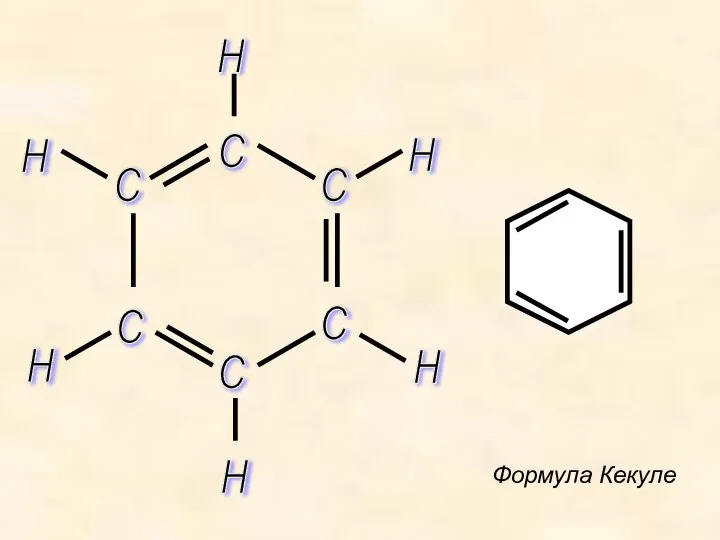
- 6. С С С С С С Формула Кекуле
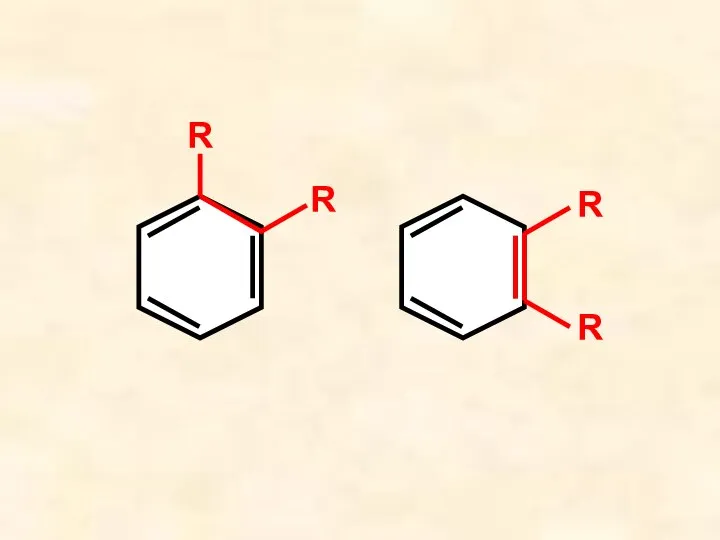
- 7. R R R R
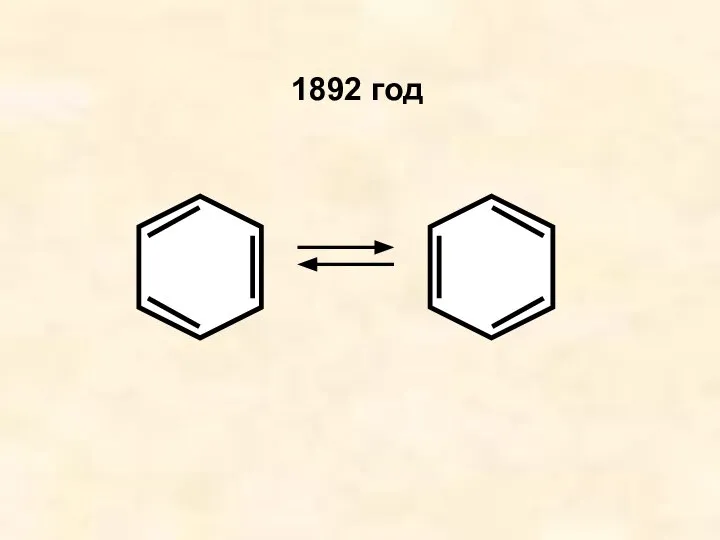
- 8. 1892 год
- 9. В 1899 г. профессор Мюнхенского университета Фридрих-Карл-Иоганнес Тиле он выдвинул гипотезу, согласно которой атомы углерода в
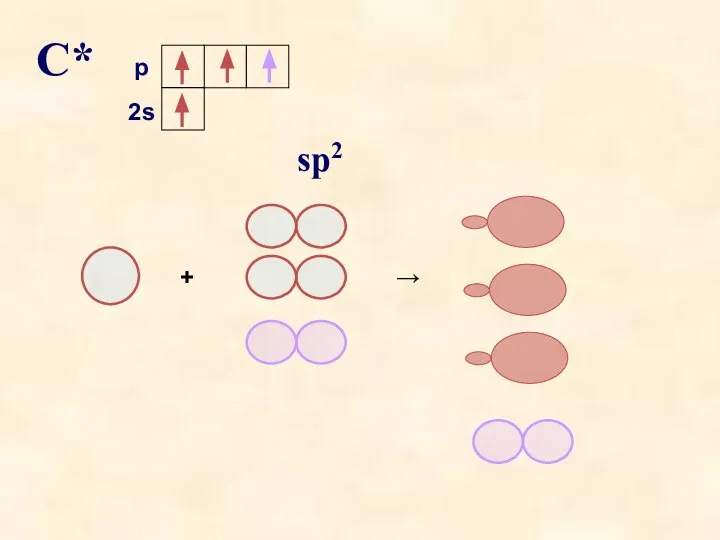
- 10. С* sp2 2s p + →
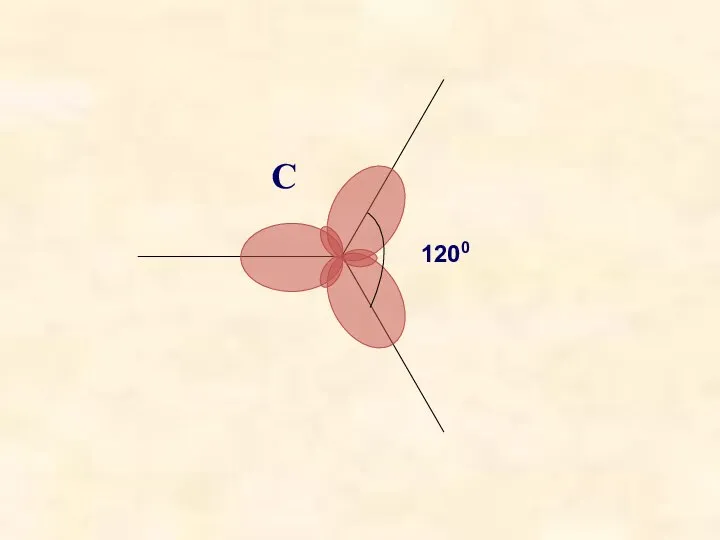
- 11. С 1200
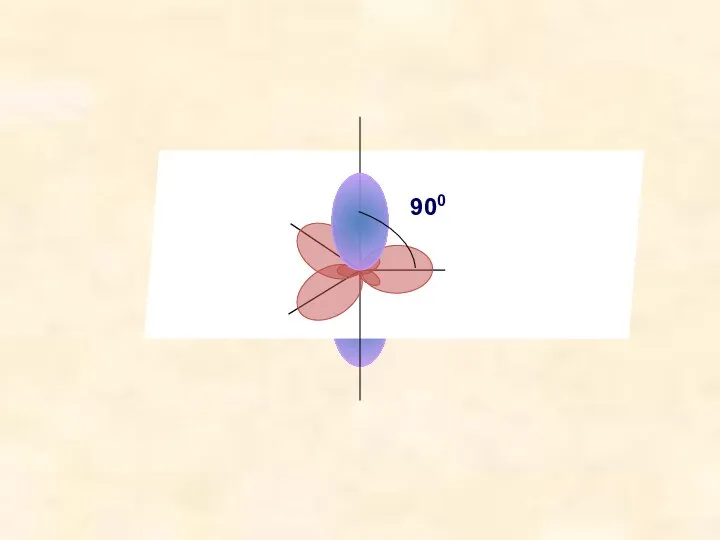
- 12. 900
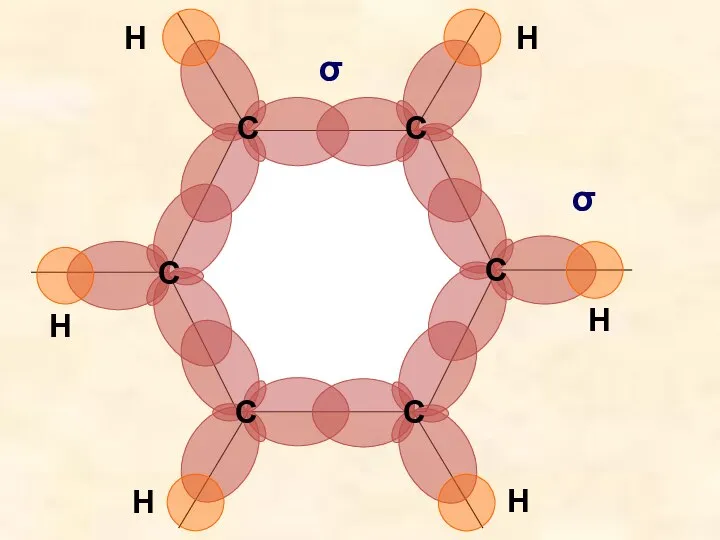
- 13. σ σ
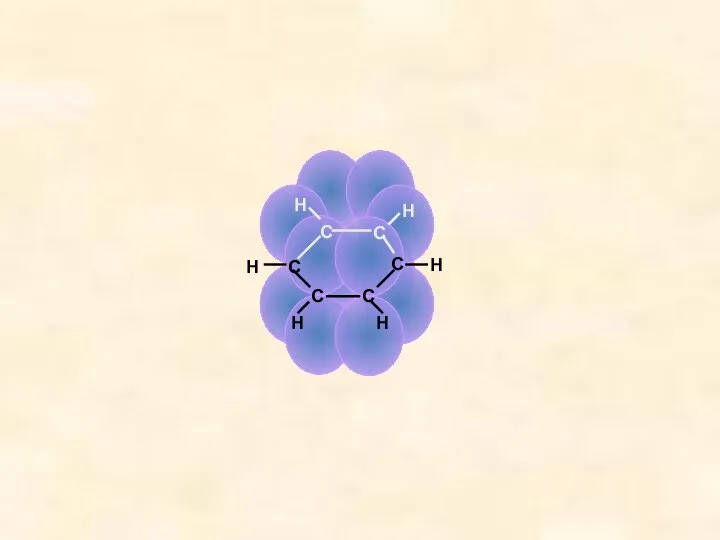
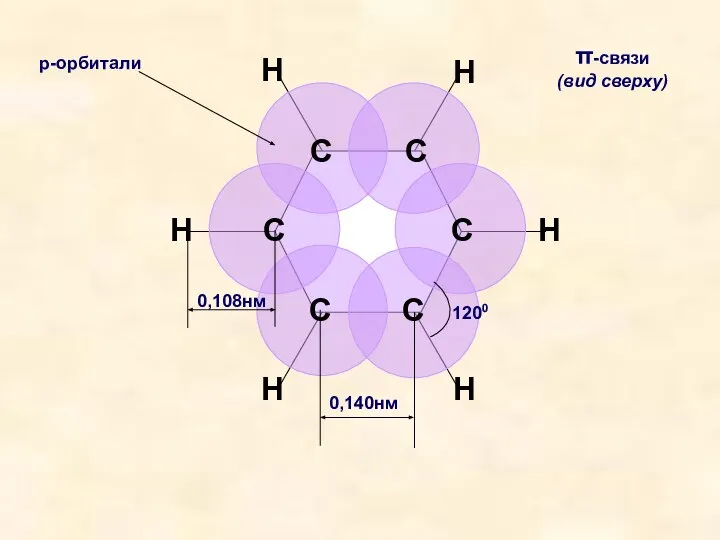
- 16. С С С С С С Н Н Н Н Н Н 0,140нм π-связи (вид сверху)
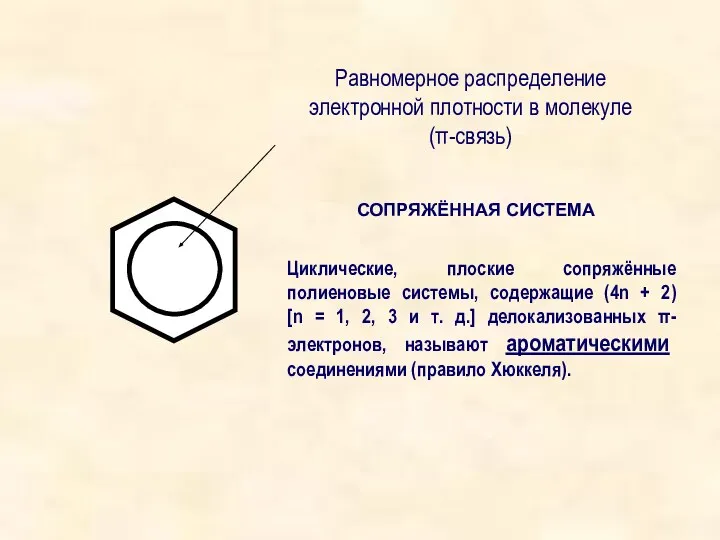
- 17. СОПРЯЖЁННАЯ СИСТЕМА Равномерное распределение электронной плотности в молекуле (π-связь) Циклические, плоские сопряжённые полиеновые системы, содержащие (4n
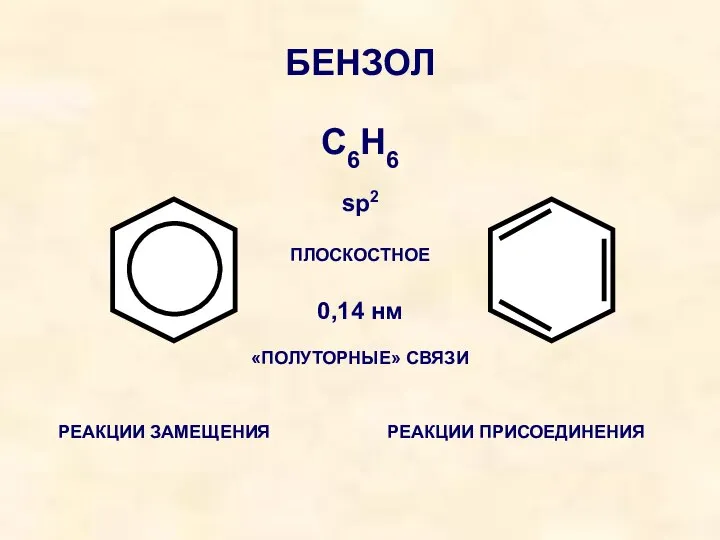
- 18. БЕНЗОЛ С6Н6 ПЛОСКОСТНОЕ sp2 0,14 нм «ПОЛУТОРНЫЕ» СВЯЗИ РЕАКЦИИ ЗАМЕЩЕНИЯ РЕАКЦИИ ПРИСОЕДИНЕНИЯ
- 19. БЕНЗОЛ – бесцветная жидкость со своеобразным запахом, не растворяется в воде, хорошо смешивается с неполярными органическими
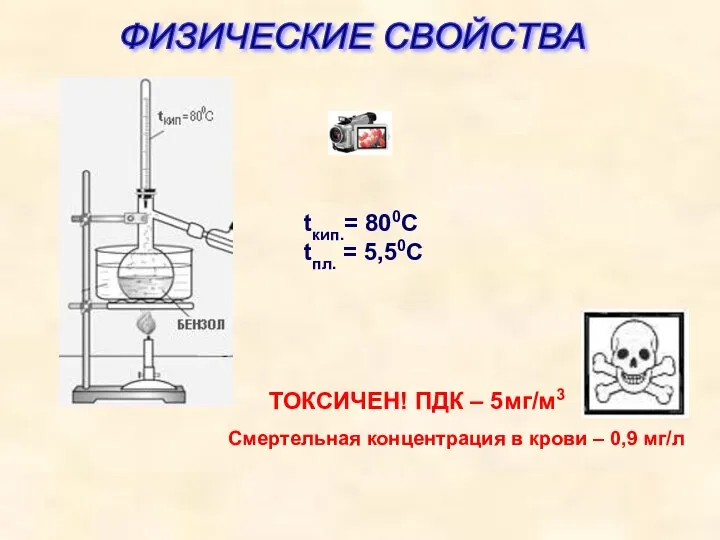
- 20. tкип.= 800С tпл. = 5,50С ТОКСИЧЕН! ПДК – 5мг/м3 Смертельная концентрация в крови – 0,9 мг/л
- 21. Горение Бензол не обесцвечивает бромную воду Бензол не окисляется сильными окислителями ХИМИЧЕСКИЕ СВОЙСТВА
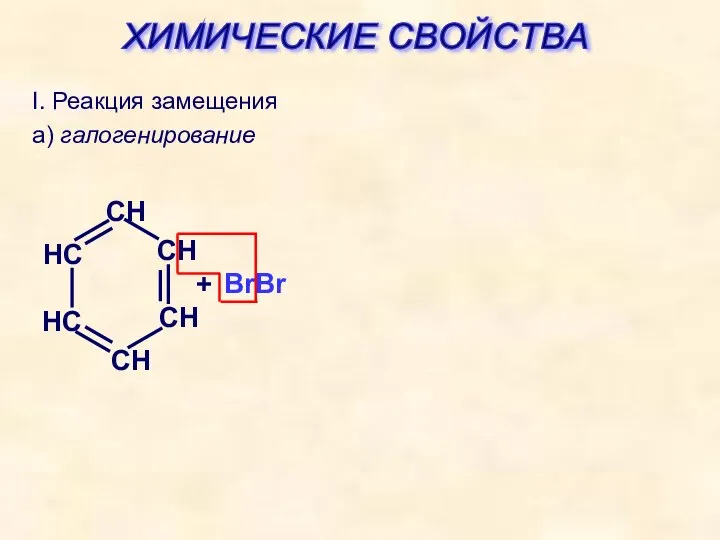
- 22. I. Реакция замещения а) галогенирование + BrBr ХИМИЧЕСКИЕ СВОЙСТВА
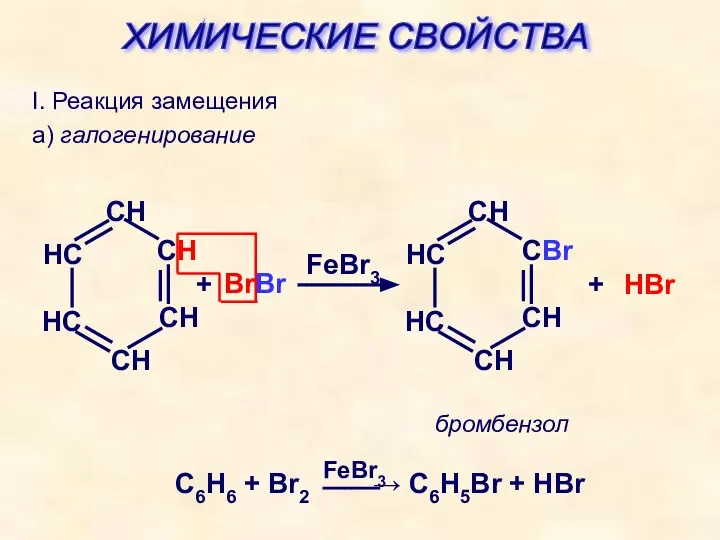
- 23. I. Реакция замещения а) галогенирование + BrBr FeBr3 + HBr бромбензол ХИМИЧЕСКИЕ СВОЙСТВА
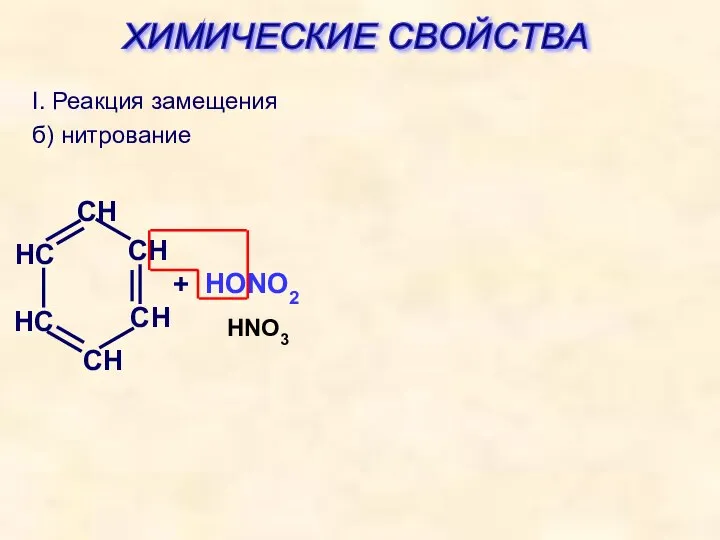
- 24. I. Реакция замещения б) нитрование + HONO2 HNO3 ХИМИЧЕСКИЕ СВОЙСТВА
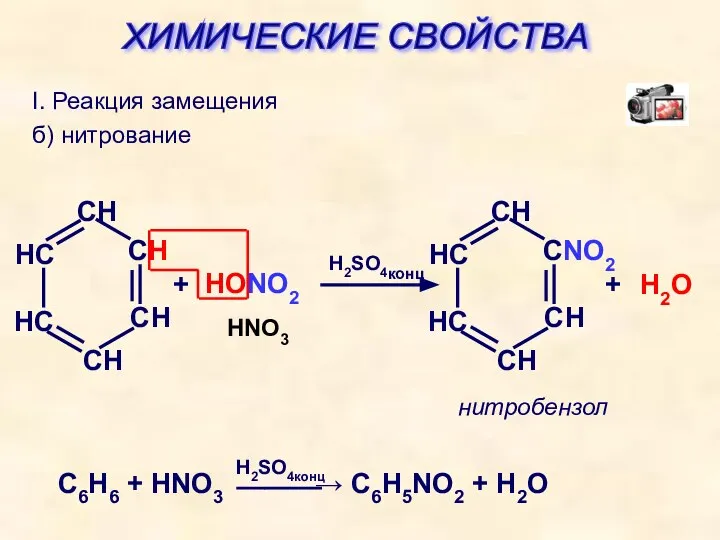
- 25. I. Реакция замещения б) нитрование + HONO2 H2SO4конц + H2O HNO3 нитробензол ХИМИЧЕСКИЕ СВОЙСТВА
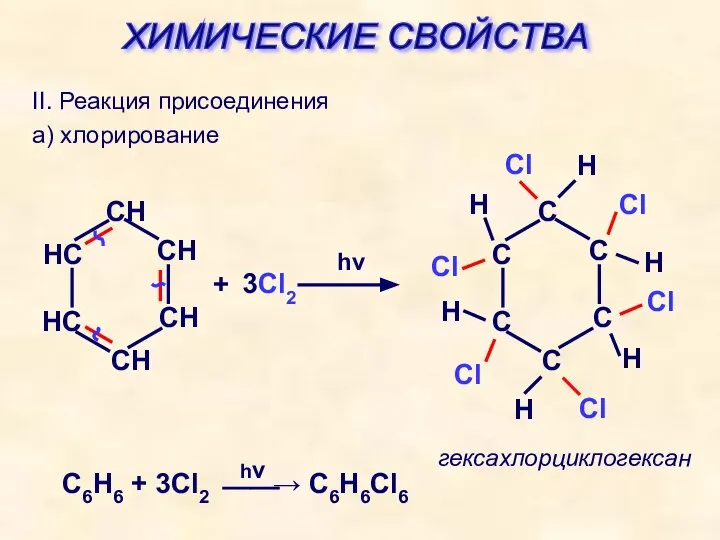
- 26. II. Реакция присоединения а) хлорирование + 3Cl2 hν гексахлорциклогексан Cl Cl Cl Cl Cl Cl ХИМИЧЕСКИЕ
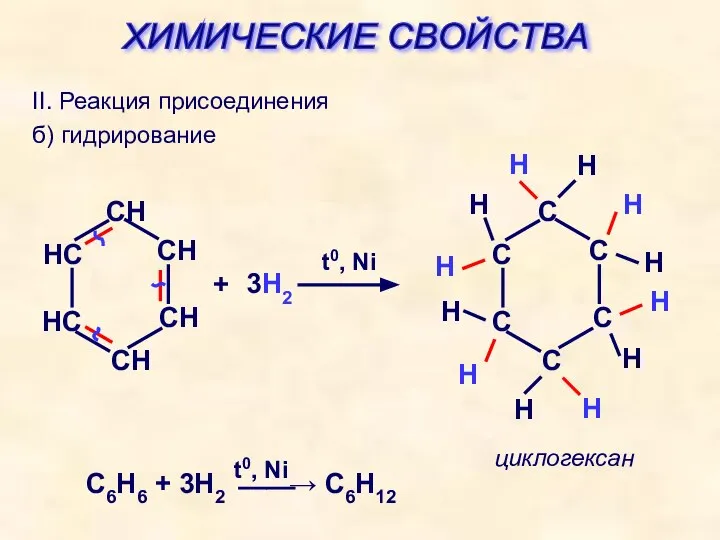
- 27. II. Реакция присоединения б) гидрирование + 3Н2 t0, Ni циклогексан Н Н Н Н Н Н
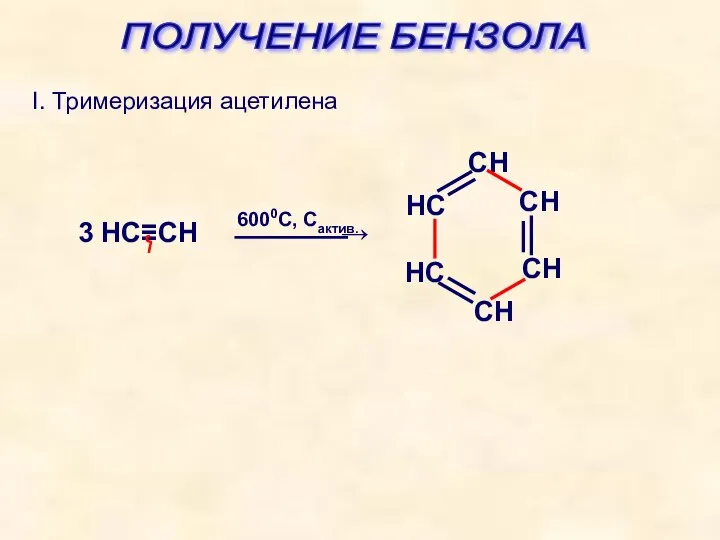
- 28. ПОЛУЧЕНИЕ БЕНЗОЛА I. Тримеризация ацетилена 3 HС≡CН ⎯⎯⎯⎯→ 6000С, Сактив.
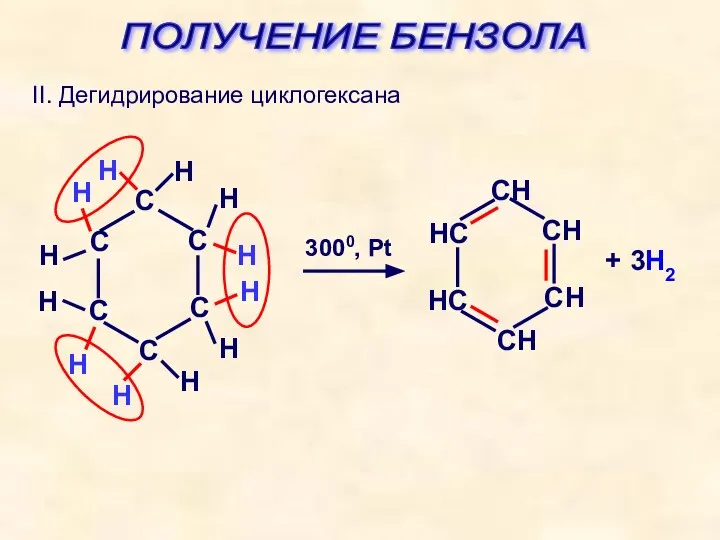
- 29. ПОЛУЧЕНИЕ БЕНЗОЛА II. Дегидрирование циклогексана + 3H2 3000, Pt
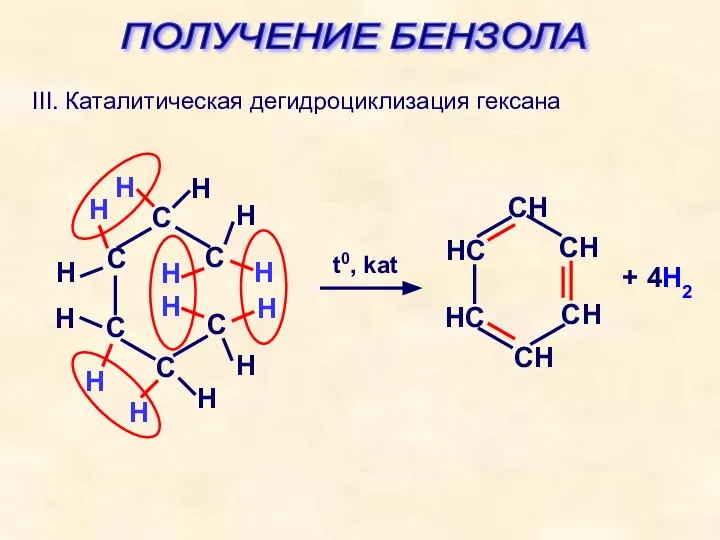
- 30. ПОЛУЧЕНИЕ БЕНЗОЛА III. Каталитическая дегидроциклизация гексана + 4H2 H С С С С С С H
- 32. Скачать презентацию








 Строение атома
Строение атома Химия – наука о веществах. Вычисления по химическим формулам. Тема 1
Химия – наука о веществах. Вычисления по химическим формулам. Тема 1 10 класс природные источники углеводородов
10 класс природные источники углеводородов Производные кислородсодержащих гетероциклов - пиранов
Производные кислородсодержащих гетероциклов - пиранов Введение в органическую химию. Состав и структура органических веществ
Введение в органическую химию. Состав и структура органических веществ Сравнительный анализ питьевой бутилированной воды
Сравнительный анализ питьевой бутилированной воды Цветные металлы и сплавы
Цветные металлы и сплавы Получение пластмасс
Получение пластмасс Кислоты. Тест
Кислоты. Тест Жидкая углекислота
Жидкая углекислота Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Основания
Основания Водород. Вода
Водород. Вода Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений 9 кл Урок 14 Ступінь дисоціації
9 кл Урок 14 Ступінь дисоціації Мышьяк. История. Нахождение в природе
Мышьяк. История. Нахождение в природе Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна
Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна Презентация 3. Теория ЕГЭ
Презентация 3. Теория ЕГЭ Химическая кинетика
Химическая кинетика Воздух
Воздух Получение дезинфицирующих средств
Получение дезинфицирующих средств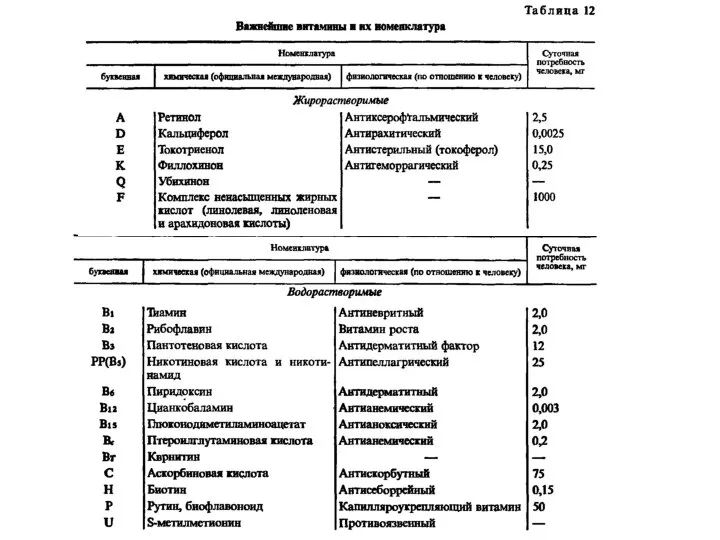 Важнейшие витамины и их номенклатура
Важнейшие витамины и их номенклатура Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Розчинність речовин, її залежність від різних чинників
Розчинність речовин, її залежність від різних чинників Алканы. Строение и изомерия
Алканы. Строение и изомерия Уравнение состояния идеального газа
Уравнение состояния идеального газа Насыщенные жирные кислоты
Насыщенные жирные кислоты Исследовательский проект. Анализ состава соков разных производителей
Исследовательский проект. Анализ состава соков разных производителей