Содержание
- 3. Характер изменения свойств элементов и соответствующих им соединений – металлические свойства ослабевают, следовательно, неметаллические, усиливаются; –
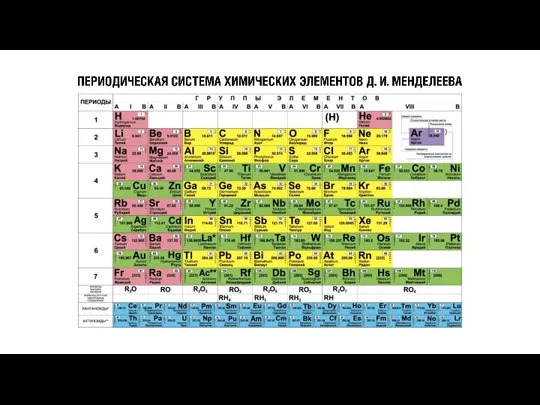
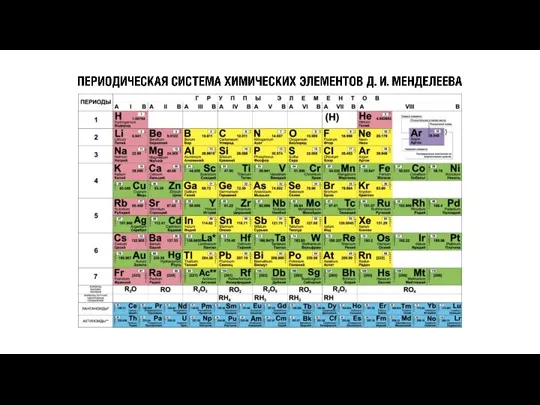
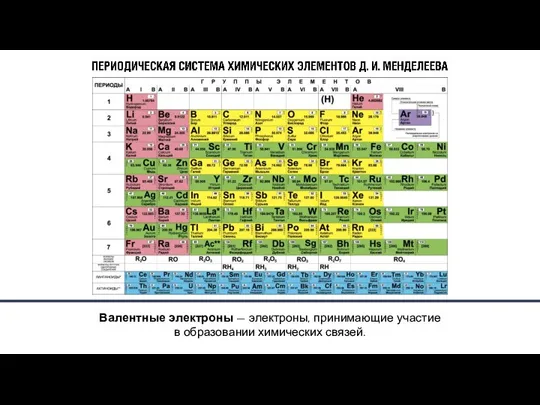
- 4. Д.И. Менделеев 1834–1907 гг. Д.И. Менделеев сделал заключение, которое получило название периодического закона: Свойства химических элементов
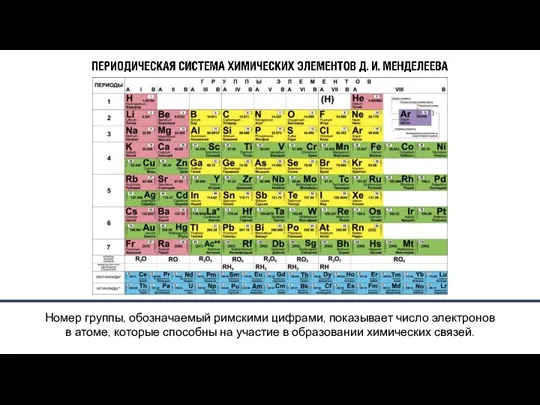
- 6. Главной характеристикой атома, согласно теории строения атома, является положительный заряд ядра, который определяет число электронов в
- 9. N — число нейтронов, А — массовое число атома, Z — атомный номер элемента. N =
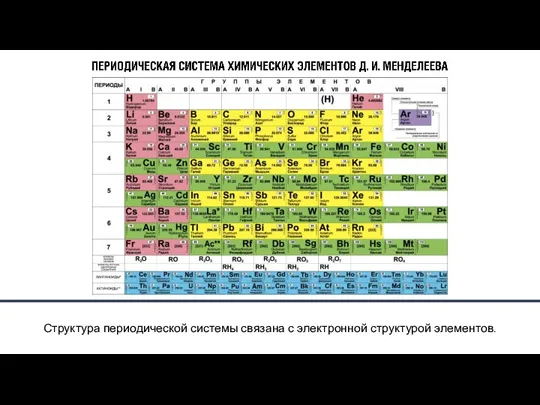
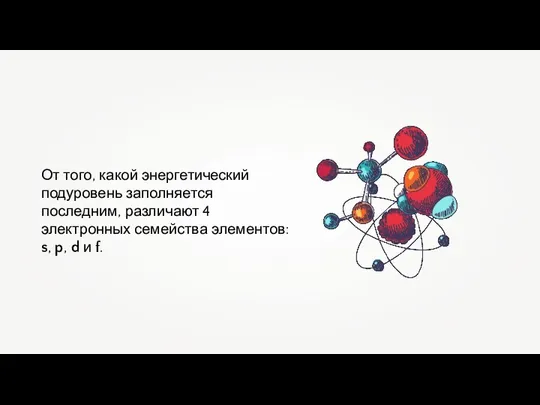
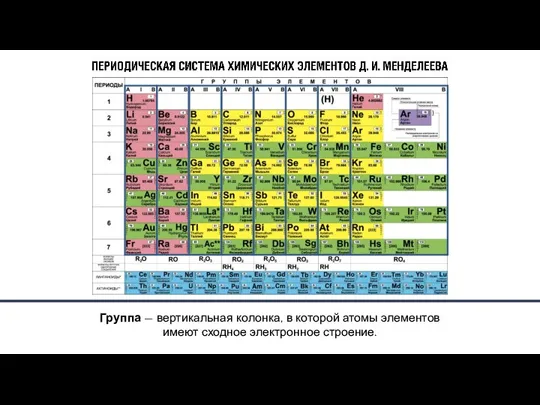
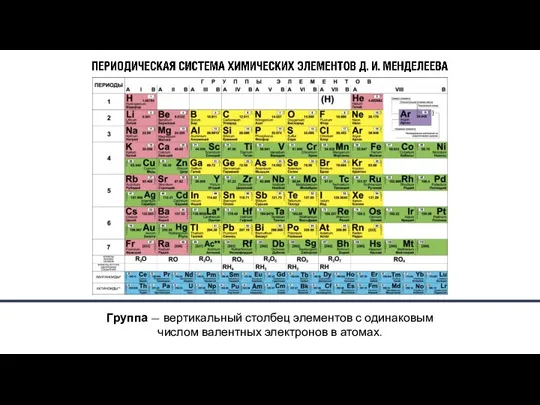
- 11. От того, какой энергетический подуровень заполняется последним, различают 4 электронных семейства элементов: s, p, d и
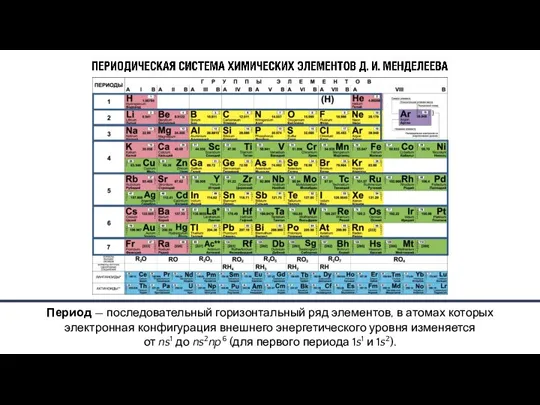
- 19. Причины изменения металлических и неметаллических свойств – заряды атомных ядер элементов и число электронов на внешнем
- 20. Причины изменения металлических и неметаллических свойств в пределах одной группы – увеличение зарядов атомных ядер элементов;
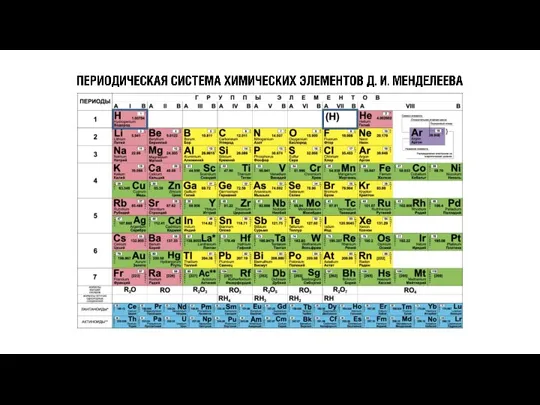
- 22. Атом водорода имеет на внешнем (единственном) электронном слое один электрон (относится к s-элементам), ввиду чего он
- 23. Учёные считают, что в космосе существует металлический водород с соответствующей ему металлической кристаллической решеткой и электронной
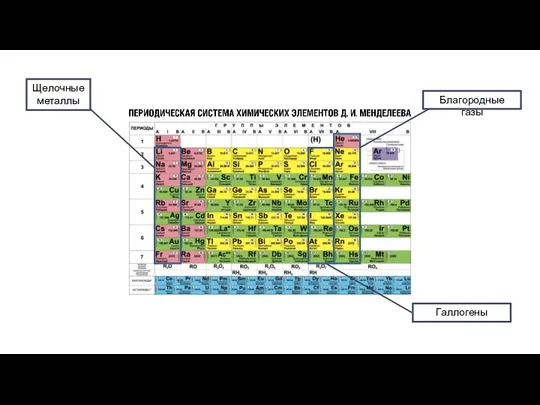
- 24. В сложных веществах в большинстве случаев водород имеет степень окисления +1, что характерно для щелочных металлов.
- 26. Скачать презентацию












 Закономерности управления каталитическими процессами. Катализ
Закономерности управления каталитическими процессами. Катализ кулонометрия Дастан
кулонометрия Дастан Коррозия металлов и ГЭ
Коррозия металлов и ГЭ Алканы. Этан
Алканы. Этан Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Классификация методов аналитической химии
Классификация методов аналитической химии Ароматические углеводороды
Ароматические углеводороды Каучук. История открытия каучука
Каучук. История открытия каучука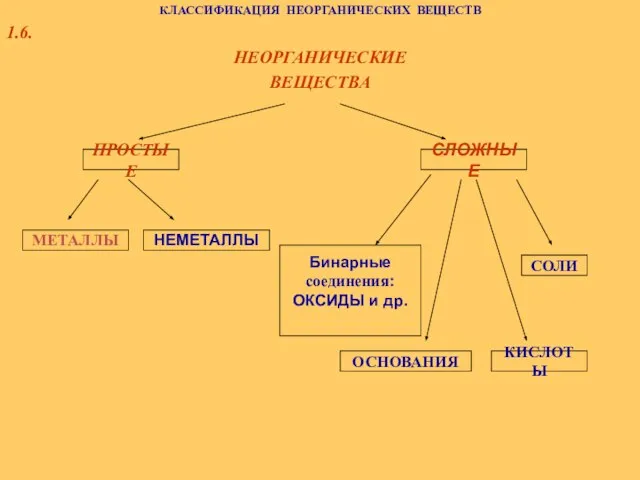 Классификация неорганических веществ
Классификация неорганических веществ Химический состав молока
Химический состав молока Стереоизомерия
Стереоизомерия Карбоновые кислоты
Карбоновые кислоты Пептиды, белки. Лабораторное занятие
Пептиды, белки. Лабораторное занятие Жаропрочные и жаростойкие стали
Жаропрочные и жаростойкие стали Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары
Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары Nevarne snovi
Nevarne snovi Кальций и его соединения
Кальций и его соединения Растворы. Часть 2
Растворы. Часть 2 Хроматография. Особенности метода хроматографии
Хроматография. Особенности метода хроматографии Презентация на тему Путешествие по континенту Химия, познавательная игра по химии, 8 класс
Презентация на тему Путешествие по континенту Химия, познавательная игра по химии, 8 класс  Нуклеинови киселини
Нуклеинови киселини Протолитическая теория кислот и оснований. Буферные растворы
Протолитическая теория кислот и оснований. Буферные растворы Амины, азо- и диазосоединения (продолжение)
Амины, азо- и диазосоединения (продолжение) Ионные равновесия в растворах
Ионные равновесия в растворах Химические вещества
Химические вещества Химическая связь
Химическая связь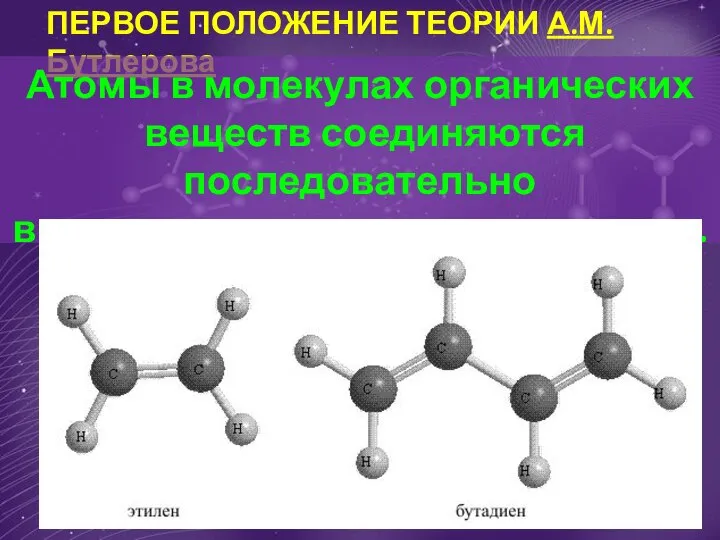 Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно
Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно