Содержание
- 2. Цель урока: сформировать у учащихся понятие гидролиза солей.
- 3. Научить учащихся определять характер среды растворов солей по их составу, составлять ионные уравнения реакций гидролиза солей
- 4. При сливании раствора, содержащего 5 моль хлорида железа(III), с избытком раствора кальцинированной соды выделяется газ и
- 5. V(FeCl3) = 5моль 2 FeCl3 +3Na2CO3= 6NaCl + Fe2(CO3)3 Дано: m (осадка)=? Решение:
- 6. Гидролиз соли - это взаимодействие ионов соли с водой. Известно, что молекула воды хотя и не
- 7. Гидролиз хлорида железа (III) FeCl3 + HOH ↔ HCl + FeOHCl2 Fe3+ +3Cl- +HOH ↔ H+
- 8. Гидролиз карбоната натрия Na2CO3 + HOH ↔ NaOH + NaHCO3 2Na+ + CO32- + HOH↔ Na+
- 9. Гидролиз хлорида натрия NaCl +HOH ↔ NaOH + HCl Na+ + Cl- + HOH ↔ Na+
- 10. Гидролиз карбоната железа (III) Fe2(CO3)3 + 3HOH → 2Fe(OH)3↓ + 3CO2↑ Соли, образованные слабым основанием и
- 11. При сливании раствора, содержащего 5 моль хлорида железа(III), с избытком раствора кальцинированной соды выделяется газ и
- 12. V(FeCl3) = 5моль 2 FeCl3 +3Na2CO3 + 3H2O= 2Fe(OH)3↓ + 3CO2↑ + 6NaCl v (Fe(OH)3) =
- 13. Бланк химического диктанта: «+» - да «-» - нет
- 14. В чистой воде рН = 7. Раствор соляной кислоты- слабый электролит. Соль Na2CO3 образована сильным основанием
- 15. Бланк химического диктанта: Оценка «3» - 5-6 правильных ответов; оценка «4» - 7-8 правильных ответов; оценка
- 16. Домашнее задание § 18, ответить на вопросы 6-8 стр. 74;
- 18. Скачать презентацию















 Предмет органической химии. Строение атома углерода
Предмет органической химии. Строение атома углерода Сера
Сера кремний и его соединения
кремний и его соединения Нефтяные дисперсные системы
Нефтяные дисперсные системы Презентация на тему Многоатомные спирты
Презентация на тему Многоатомные спирты  Substancje chemiczne
Substancje chemiczne Оксиды в мире минералов
Оксиды в мире минералов Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла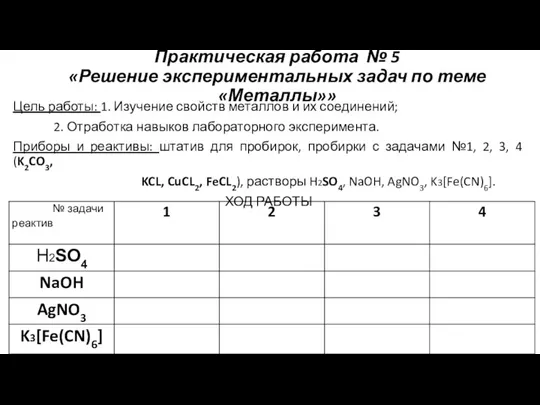 Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Химическое равновесие
Химическое равновесие Всероссийский межпредметный командный проект Изучаем химию с Агатой Кристи
Всероссийский межпредметный командный проект Изучаем химию с Агатой Кристи Химический диктант как метод формирующего оценивания
Химический диктант как метод формирующего оценивания Строение бензола
Строение бензола Свойства бензола
Свойства бензола Химическая технология. Структура ВКР
Химическая технология. Структура ВКР Расчет энтропии образования и теплоемкости органических веществ методом Бенсона
Расчет энтропии образования и теплоемкости органических веществ методом Бенсона Типы химических реакций
Типы химических реакций Химия – это область чудес
Химия – это область чудес Химическая связь и строение молекул
Химическая связь и строение молекул Классы неорганических соединений
Классы неорганических соединений Презентация на тему Золото
Презентация на тему Золото  Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Движение электрона в атоме
Движение электрона в атоме Неметаллы и их соединения
Неметаллы и их соединения Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Понятие об ароматических спиртах и фенолах. Особенности строения фенола
Понятие об ароматических спиртах и фенолах. Особенности строения фенола Использование катионных красителей в экстракционно-флуориметрическом анализе
Использование катионных красителей в экстракционно-флуориметрическом анализе Фосфор
Фосфор