Слайд 2 «Надо учиться не для того, чтобы стать учёным, а только для

того, чтобы научиться жить лучше» Лев Толстой
«Три пути ведут к знанию: путь размышления - это самый благородный; путь подражания - это путь самый лёгкий и путь опыта - это путь самый горький» Конфуций
Слайд 3Ионные реакции
В растворе электролиты распадаются на ионы и между ними могут

протекать химические реакции
Данные реакции называются ионными реакциями
Уравнения этих реакций называются ионными уравнениями
Слайд 4Условия протекания реакций ионного обмена
Если образуется осадок (↓)
Если выделяется газ (↑)
Если образуется

малодиссоциируемое вещество (например, вода)
Слайд 5Алгоритм составления реакций ионного обмена
Опыт 1
Написать молекулярное уравнение
2NaOH + H₂SO₄ = Na₂SO₄

+ 2H₂O
Слайд 6Правила составления уравнений
Вещества- электролиты записываем в виде ионов на которые они распадаются

в растворе, с учетом коэффициентов и индексов.
Формулы нерастворимых, газообразных и малодиссоциирующих веществ оставляем в молекулярном виде.
Слайд 7Правила составления уравнений
коэффициент перед формулой вещества относится к обоим ионам ;
формулы многоатомных

(сложных) ионов не разрывают – ОН⁻, СО₃²⁻, NО₃⁻, SО₄²⁻, РО₄³⁻, НСО₃ˉ , НРО₄²⁻ и т.п.
индекс после иона переходит в ионном уравнении в коэффициент перед ним.
Слайд 8Правила составления уравнений
2Na+ + 2OH- + 2H+ + SO4²- = 2Na+ +

SO4²- + 2 H2O
Получаем полное ионное уравнение
Слайд 9Правила составления уравнений
Определим одинаковые ионы, то есть ионы, не участвующие в реакции

(они находятся в правой и левой части уравнения в одинаковом количестве). Формулы этих ионов можно вычеркнуть (или подчеркнуть):
2Na ⁺ + 2OH⁻ +2H⁺ +SO₄²⁻ = 2Na⁺ +SO₄²⁻ + 2H2O
Слайд 10Правила составления уравнений
Перепишем только те формулы, которые остались:
2OH ⁻ + 2H ⁺

=2H₂O
OH ⁻ + H⁺ = H₂O
Получаем сокращённое ионное уравнение
Слайд 11Вывод
Сокращённое ионное уравнение выражает сущность реакции ионного обмена

Слайд 12Опыт 2 Образование осадка
FeCI₃ + 3NaOH = Fe(OH)₃↓+ 3NaCI
Fe³⁺ +3CI⁻ +3Na⁺ +3OH⁻

= Fe(OH)₃↓ + 3Na⁺+ 3CI⁻
Fe³⁺ + 3OH⁻ = Fe(OH)₃↓
Слайд 13Опыт 3 Растворение осадка
2Fe(OH)₃↓+3H₂SO₄ = Fe₂(SO₄)₃+ 6H₂O
2Fe(OH)₃↓+6H⁺+3SO₄²⁻=2Fe³⁺+3SO₄²⁻ +6H₂O
2Fe(OH)₃↓+6H⁺= 2Fe³⁺+ 6H₂O

Слайд 14Опыт 4 Выделение газа
Na₂CO₃+2HCI = 2NaCI + CO₂↑+H₂O
2Na⁺+ CO₃²⁻+2H⁺+2CI⁻ = 2Na⁺ +2CI⁻+
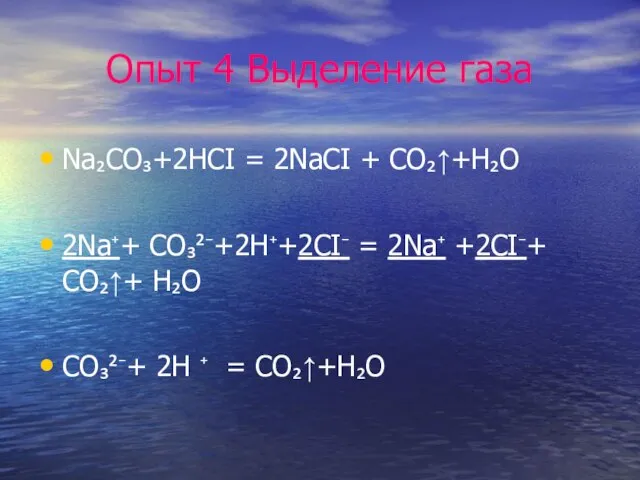
CO₂↑+ H₂O
CO₃²⁻+ 2H ⁺ = CO₂↑+H₂O













 Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Определение плотности газообразного вещества по плотности
Определение плотности газообразного вещества по плотности Воздух
Воздух Презентация на тему Керамика
Презентация на тему Керамика  Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Основы трибологии и триботехники. Смазка и смазочные материалы
Основы трибологии и триботехники. Смазка и смазочные материалы Синтетические материалы
Синтетические материалы Самостоятельная работа
Самостоятельная работа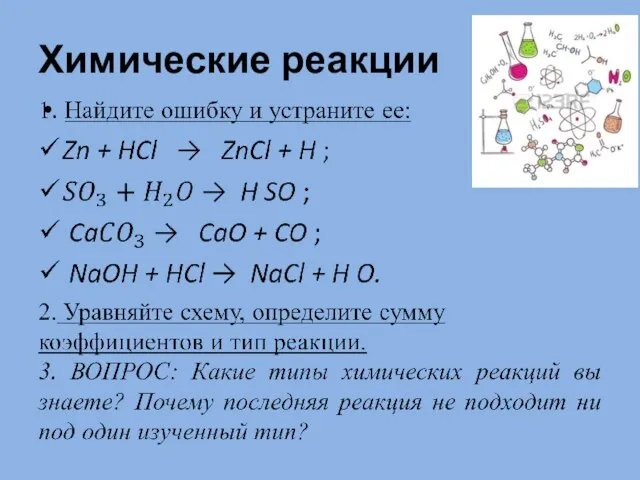 Химические реакции
Химические реакции Основы переработки нефти и нефтепродуктов
Основы переработки нефти и нефтепродуктов Презентация на тему Соли аммония
Презентация на тему Соли аммония  Кислород
Кислород Полимеры
Полимеры Хром (Cr)
Хром (Cr) Простые вещества - металлы
Простые вещества - металлы Магний
Магний Металлическая, водородная, Ван-дер-ваальсова химические связи
Металлическая, водородная, Ван-дер-ваальсова химические связи Подготовка проб товаров к анализу. Химико-аналитический контроль
Подготовка проб товаров к анализу. Химико-аналитический контроль Ртуть. Правила работы со ртутью
Ртуть. Правила работы со ртутью Vvedenie_v_khimiyu
Vvedenie_v_khimiyu Триметилалюминий
Триметилалюминий Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Периодический закон и Периодическая система химических элементов Д. И. Менделеева
Периодический закон и Периодическая система химических элементов Д. И. Менделеева Использование культурологического компонента на уроках химии
Использование культурологического компонента на уроках химии Презентация на тему Кристаллы
Презентация на тему Кристаллы  Металлы. Атомы металлов
Металлы. Атомы металлов Минерал дунит
Минерал дунит