Содержание
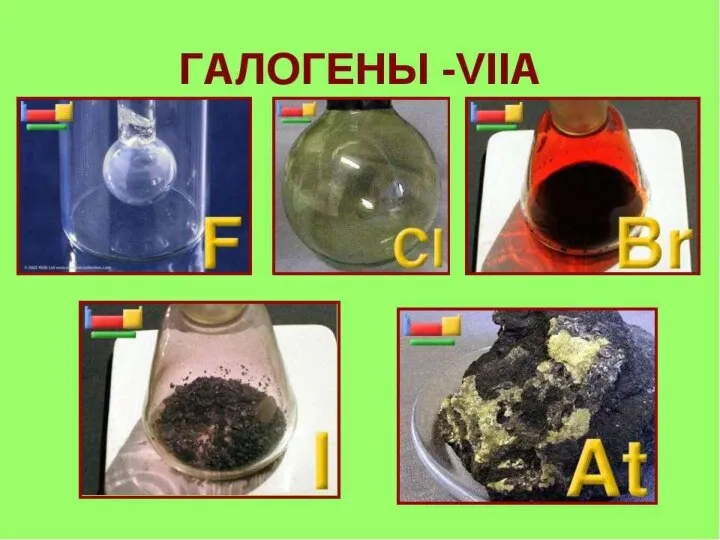
- 8. Галогены Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппыVIIгруппы периодической
- 10. ПОЛУЧЕНИЕ ГАЛОГЕНОВ 1. Электролиз растворов и расплавов галогенидов: 2NaCl + 2H2O = Cl2+ H2+ 2NaOH 2KF
- 11. Строение атомов галогенов F+9 ) ) 2 7 Cl+17 ) ) ) 2 8 7 Br+35
- 18. Качественные реакции на галогенид-ионы Качественные реакции на хлориды, бромиды и йодиды -образование нерастворимых галогенидов серебра: NaCl
- 19. Химические свойства Рассмотрим свойства галогенов на примере хлора: 1.Взаимодействие с металлами 2K + Cl2→2KCl Mg +
- 25. Скачать презентацию
Слайд 8
Галогены Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппыVIIгруппы периодической
Галогены Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппыVIIгруппы периодической

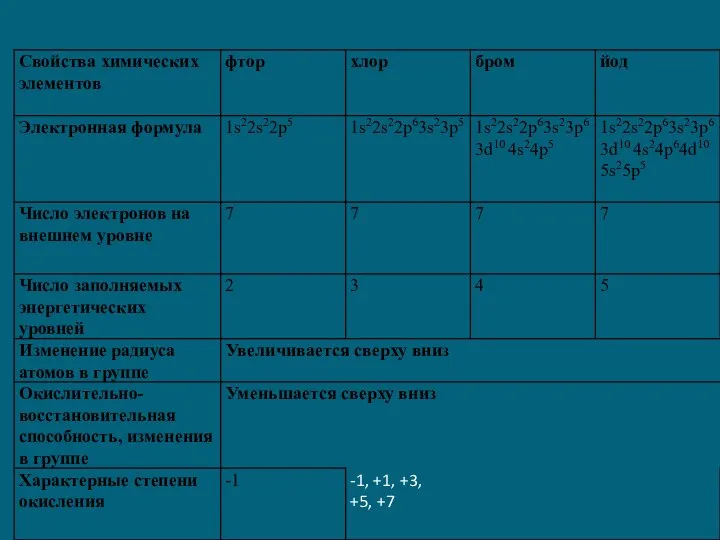
Фтор
F +9)2)7 …2s22p5
Хлор
Cl +17)2)8)7 …3s23p5
Бром
Br +35)2)8)18)7 …4s24p5
Йод
I +53)2)8)18)18)7 …5s25p5
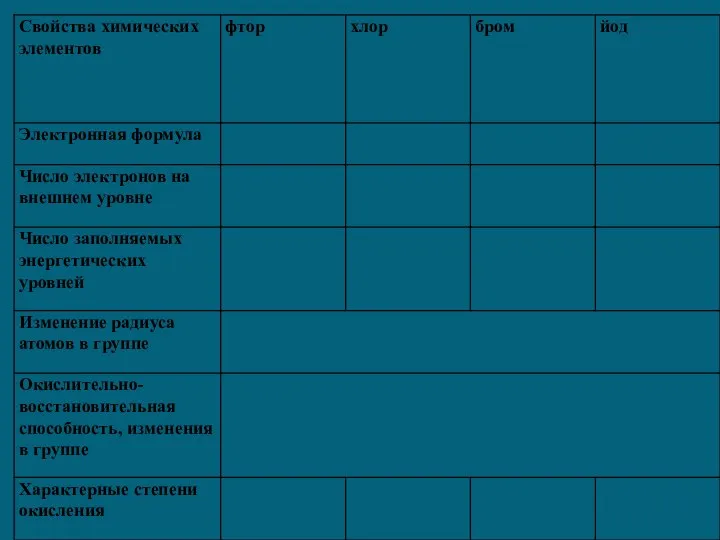
1) Общая электронная конфигурация внешнего энергетического уровня - nS2nP5.
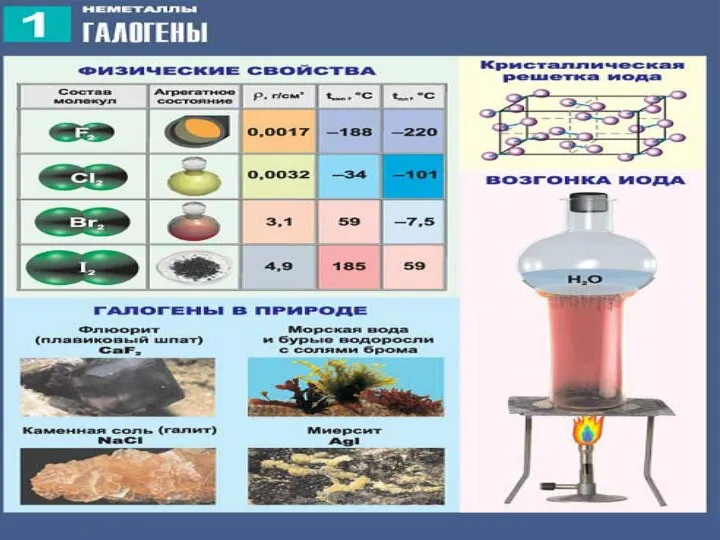
2) С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
3) С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
Слайд 10ПОЛУЧЕНИЕ ГАЛОГЕНОВ
1. Электролиз растворов и расплавов галогенидов:
2NaCl + 2H2O = Cl2+ H2+
ПОЛУЧЕНИЕ ГАЛОГЕНОВ
1. Электролиз растворов и расплавов галогенидов:
2NaCl + 2H2O = Cl2+ H2+

2KF = 2K + F2 (единственный способ полученияя F2)
2. Окисление галогенводородов:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O – Лабораторный способ получения хлора
14HBr+K2Cr2O7=2KBr+2CrBr3+3Br2+7H2O
MnO2 + 4HHal = MnHal2 + Hal2 + 2 H2O– Лабораторный - (Для получения хлора, брома, иода)
3. Промышленный способ – окисление хлором (для брома и йода):
2KBr+Cl2=2KCl+Br2
2KI + Cl2=2KCl + I2
Слайд 11Строение атомов галогенов
F+9 ) )
2 7
Cl+17 ) )
Строение атомов галогенов
F+9 ) )
2 7
Cl+17 ) )
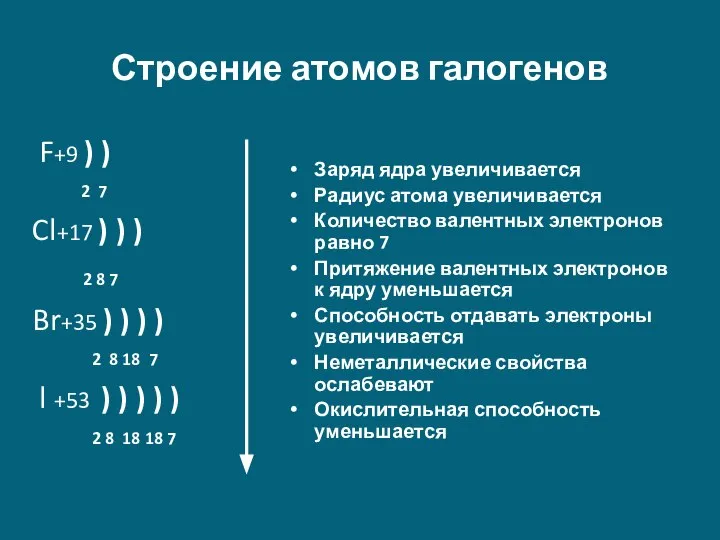
2 8 7
Br+35 ) ) ) )
2 8 18 7
l +53 ) ) ) ) )
2 8 18 18 7
Заряд ядра увеличивается
Радиус атома увеличивается
Количество валентных электронов равно 7
Притяжение валентных электронов к ядру уменьшается
Способность отдавать электроны увеличивается
Неметаллические свойства ослабевают
Окислительная способность уменьшается
Слайд 18Качественные реакции на галогенид-ионы
Качественные реакции на хлориды, бромиды и йодиды -образование нерастворимых
Качественные реакции на галогенид-ионы
Качественные реакции на хлориды, бромиды и йодиды -образование нерастворимых

NaCl + AgNO3 → AgCl↓ + NaNO3
белый творожистый осадок
NaBr + AgNO3 → AgBr↓ + NaNO3
желтоватый творожистый осадок
NaI + AgNO3 → AgI↓ + NaNO3
желтый творожистый осадок
Слайд 19Химические свойства
Рассмотрим свойства галогенов на примере хлора:
1.Взаимодействие с металлами
2K + Cl2→2KCl
Mg +
Химические свойства
Рассмотрим свойства галогенов на примере хлора:
1.Взаимодействие с металлами
2K + Cl2→2KCl
Mg +

2.Реакции с неметаллами
H2 + Cl2 → 2HCl
3.Взаимодействие со щелочами на холоду
2NaOH + Cl2 → NaCl + NaClO + H2O
4.Взаимодействие со щелочами при нагревании
6NaOH + 3Cl2 → 5NaCl + NaClO3 + 3H2O
5.Вытеснение менее активных галогенов из галогенидов
2KBr + Cl2 → 2KCl + Br2
6. С водой
H2O + Cl2 ↔ HCl + HClO (хлорная вода)











 Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Массовая доля вещества в смеси. Таблица
Массовая доля вещества в смеси. Таблица Презентация на тему Полимеры и их получение
Презентация на тему Полимеры и их получение  Новые грани парфюмерии. Задача 5
Новые грани парфюмерии. Задача 5 Метод ТРИЗ (теория решения изобретательских задач) при обучении химии
Метод ТРИЗ (теория решения изобретательских задач) при обучении химии Презентация на тему Многообразие карбоновых кислот
Презентация на тему Многообразие карбоновых кислот  Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Гидрокрекинг
Гидрокрекинг Силикатная промышленность
Силикатная промышленность Презентация на тему Почему протекают химические реакции
Презентация на тему Почему протекают химические реакции  Строение материалов. Дефекты кристаллической структуры
Строение материалов. Дефекты кристаллической структуры ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел?
ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел? История органической химии. Урок химии в 10 классе
История органической химии. Урок химии в 10 классе Масляная кислота
Масляная кислота 11 класс 15.09
11 класс 15.09 Белый фосфор
Белый фосфор Оксид цинка ZnO
Оксид цинка ZnO Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации Презентация на тему Коррозия
Презентация на тему Коррозия  Презентация на тему Метан и его свойства
Презентация на тему Метан и его свойства  Йод. Положение в периодической системе
Йод. Положение в периодической системе Стеариновая кислота
Стеариновая кислота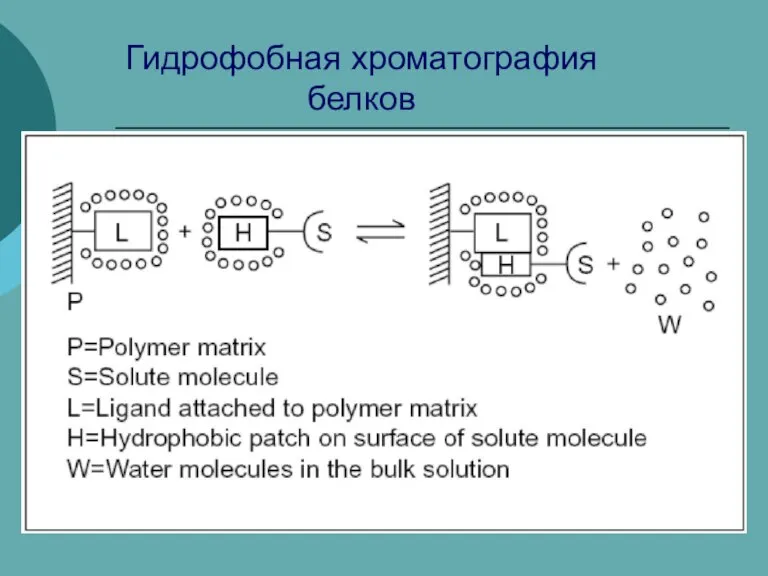 Гидрофобная хроматография белков
Гидрофобная хроматография белков Химическая промышленность. Аварии на химических предприятиях
Химическая промышленность. Аварии на химических предприятиях Цельное молоко: полезно или опасно для здоровья? (сравнительная характеристика качества восстановленного и цельного молока)
Цельное молоко: полезно или опасно для здоровья? (сравнительная характеристика качества восстановленного и цельного молока) Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи
Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи Химическое равновесие в гомогенных системах
Химическое равновесие в гомогенных системах Способы получения чистых веществ в лаборатории
Способы получения чистых веществ в лаборатории