Содержание
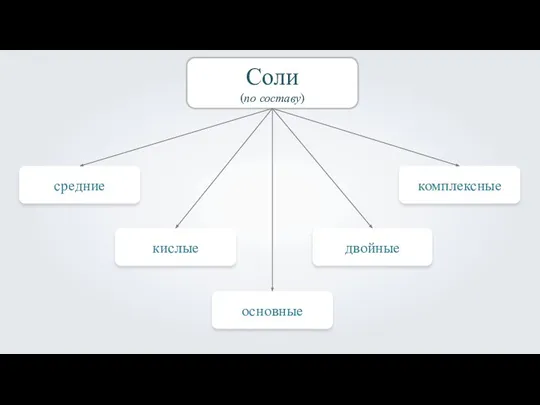
- 2. Соли (по составу) средние кислые основные двойные комплексные
- 3. Реакции средних солей 1. Взаимодействие соли и кислоты. 2. Взаимодействие соли и щёлочи. 3. Взаимодействие двух
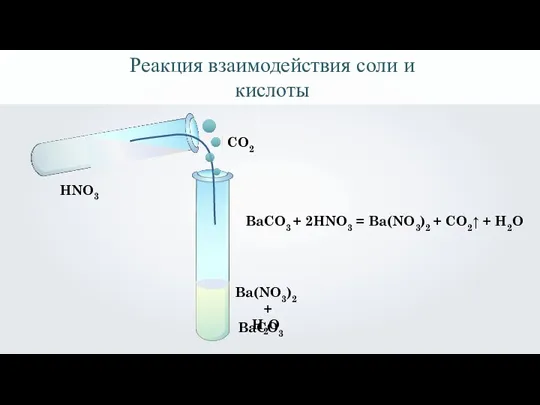
- 4. Реакция взаимодействия соли и кислоты соль + кислота → другая соль + другая кислота Реакция протекает
- 5. Реакция взаимодействия соли и кислоты BaCO3 HNO3 BaCO3 + 2HNO3 = Ba(NO3)2 + CO2↑ + H2O
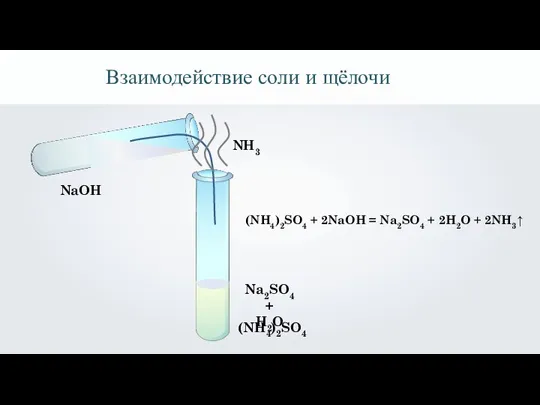
- 6. Взаимодействие соли и щёлочи соль + основание → другая соль + другое основание Реакция протекает до
- 7. (NH4)2SO4 NaOH (NH4)2SO4 + 2NaOH = Na2SO4 + 2H2O + 2NH3↑ NH3 Взаимодействие соли и щёлочи
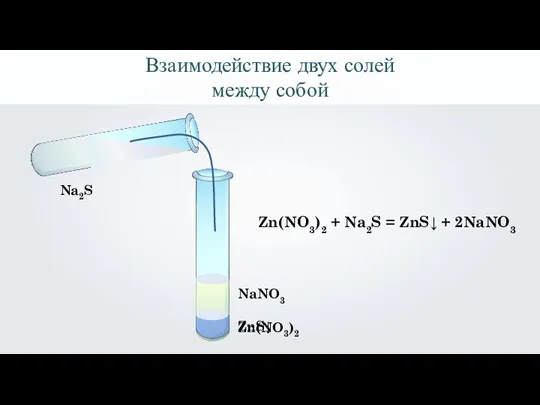
- 8. соль1 + соль2 → другая соль1 + другая соль2 Взаимодействие двух солей между собой Реакция протекает
- 9. Взаимодействие двух солей между собой Zn(NO3)2 Na2S ZnS↓ NaNO3 Zn(NO3)2 + Na2S = ZnS↓ + 2NaNO3
- 10. соль + металл → другая соль + другой металл Взаимодействие соли и металла Реакция протекает только
- 11. Бекетов Николай Николаевич 1865 год – изучение реакционной способности одних металлов вытеснять из солей другие металлы
- 12. Вытеснительный ряд металлов Mg → Al → Zn → Cr → Fe → Co → Sn
- 13. Правила протекания реакций С растворами кислот взаимодействуют металлы, которые расположены левее водорода в соответствии с электрохимическим
- 14. Правила протекания реакций Каждый металл вытесняет из раствора солей другие металлы, расположенные правее его в электрохимическом
- 16. Скачать презентацию









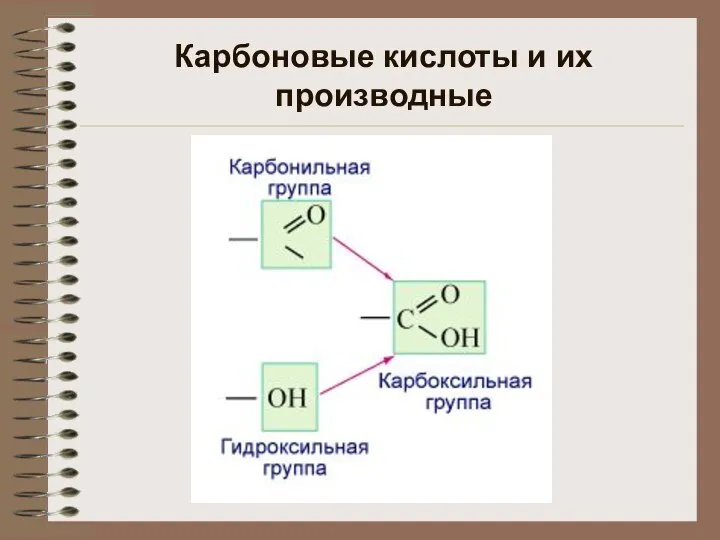 Карбоновые кислоты и их производные
Карбоновые кислоты и их производные Активные формы кислорода (АФК) Reactive Oxygen Species (ROS)
Активные формы кислорода (АФК) Reactive Oxygen Species (ROS) Сера
Сера Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В.
Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В. Домашняя работа по теме Фенол
Домашняя работа по теме Фенол Хладостойкие неметаллические материалы
Хладостойкие неметаллические материалы Драгоценный металл золото
Драгоценный металл золото Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Вуглеводи
Вуглеводи Общие свойства неметаллов
Общие свойства неметаллов Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ
Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ Химия вокруг нас. 10 класс
Химия вокруг нас. 10 класс Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Железо и его соединения
Железо и его соединения Алюминий. 9 класс
Алюминий. 9 класс Коррозия металлов. Электрохимическая коррозия
Коррозия металлов. Электрохимическая коррозия Состав популярных напитков, рН-группа
Состав популярных напитков, рН-группа Аммиак
Аммиак Занимательная химия Программу составил
Занимательная химия Программу составил  Структура и свойства латуни. Изучение структуры латунного спая лемеха
Структура и свойства латуни. Изучение структуры латунного спая лемеха Классификация органических веществ
Классификация органических веществ Классификация реакций
Классификация реакций Сульфаты (2)
Сульфаты (2) Презентация на тему Спирты (9 класс)
Презентация на тему Спирты (9 класс)  Азот и его соединения
Азот и его соединения Реакция нейтрализации
Реакция нейтрализации Растворы. Определение
Растворы. Определение