Содержание
- 2. Жидкий азот Жидкий азот —не взрывоопасен и не ядовит. Испаряясь, азот охлаждает очаг возгорания и вытесняет
- 3. Применение жидкого азота ; для охлаждения различного оборудования и техники; для охлаждения компонентов компьютера при экстремальном
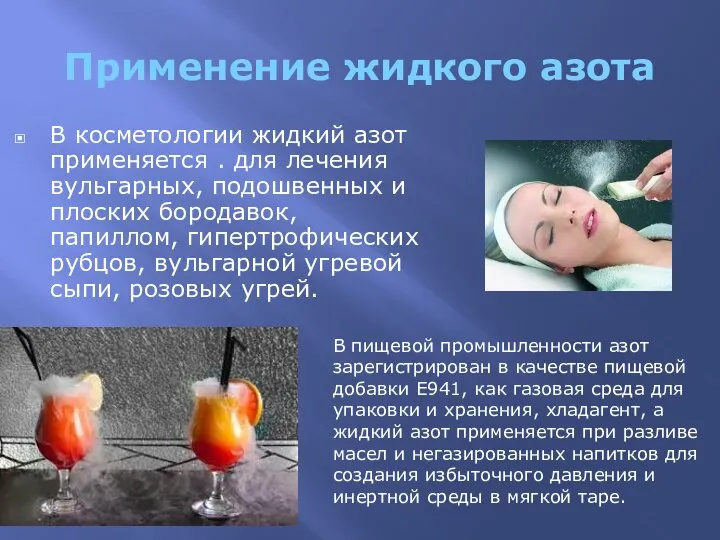
- 4. Применение жидкого азота В косметологии жидкий азот применяется . для лечения вульгарных, подошвенных и плоских бородавок,
- 5. Поведение веществ в жидком азоте Вещества в жидком азоте становятся хрупкими
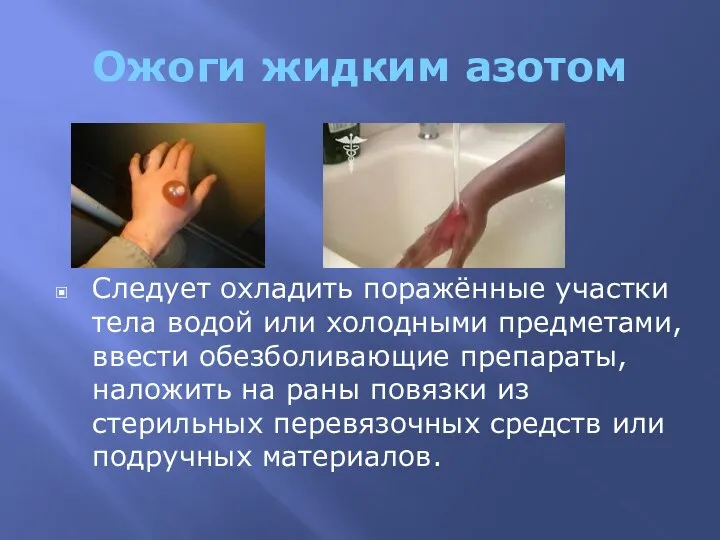
- 6. Ожоги жидким азотом Следует охладить поражённые участки тела водой или холодными предметами, ввести обезболивающие препараты, наложить
- 7. Кессонная болезнь Кессонная болезнь возникает при быстром снижении давления (например, при всплытии с глубины, выхода из
- 8. Химические свойства азота В химическом отношении азот довольно инертный газ из-за прочной ковалентной связи, атомарный же
- 9. Аммиак . Аммиа́к— NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом
- 10. Аммиак - опасен В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака
- 11. Химические свойства аммиака NH3 – сильный восстановитель. 1. Горение аммиака (при нагревании) 4NH3 + 3O2 →
- 12. ВЗАИМОДЕЙСТВИЕ АММИАКА С ВОДОЙ И КИСЛОТАМИ И водный раствор аммиака, и соли аммония содержат особый ион
- 13. Получение аммиака лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ +
- 14. Соли аммония вступают в обменную реакцию с кислотами и солями: (NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓
- 15. Оксиды азота 2NO2 + H2O = HNO3 + HNO2, 4NO2 + 2H2O + О2 = 4HNO3.
- 16. Азотная кислота Температура кипения азотной кислоты +83 °С, температура замерзания –41 °С, т.е. при обычных условиях
- 17. Взаимодействие с металлами Концентрированная азотная кислота Me + HNO3(конц.) → соль + вода + NO2 С
- 18. Взаимодействие с металлами Разбавленная азотная кислота Продукт восстановления азотной кислоты в разбавленном растворе зависит от активности
- 19. Получение азотной кислоты NaNO3 + H2SO4 = NaHSO4 + HNO3 4NH3 + 5O2 → 4NO +
- 21. Скачать презентацию
















 Реакции в органической химии
Реакции в органической химии Презентация на тему Кристаллические решетки 9 класс
Презентация на тему Кристаллические решетки 9 класс  Явления, смеси и способы их разделения
Явления, смеси и способы их разделения Лекция_классы_неогранических_соединений
Лекция_классы_неогранических_соединений Металлы
Металлы Физические и химические явления
Физические и химические явления Методы выделения и разделения радионуклидов
Методы выделения и разделения радионуклидов Арены. Бензол
Арены. Бензол Основные классы неорганических веществ
Основные классы неорганических веществ Презентация на тему Щелочноземельные металлы
Презентация на тему Щелочноземельные металлы  Теоретические основы органической химии. Лекция 25
Теоретические основы органической химии. Лекция 25 Степень окисления
Степень окисления Получение металлов в промышленности. Чёрная металлургия
Получение металлов в промышленности. Чёрная металлургия Силикатная промышленность и её продукция
Силикатная промышленность и её продукция Химическая технология органических веществ
Химическая технология органических веществ Дорогие и дешёвые лекарства: Чем похожи и чем отличаются друг от друга?
Дорогие и дешёвые лекарства: Чем похожи и чем отличаются друг от друга? валентность (1)
валентность (1) Электролиз и его применение
Электролиз и его применение Лавка возможностей
Лавка возможностей Презентация на тему Твердые вещества
Презентация на тему Твердые вещества  Стекло. Технология изготовления стекла
Стекло. Технология изготовления стекла Физико-химическая механика и реология дисперсных структур. Лекция 15
Физико-химическая механика и реология дисперсных структур. Лекция 15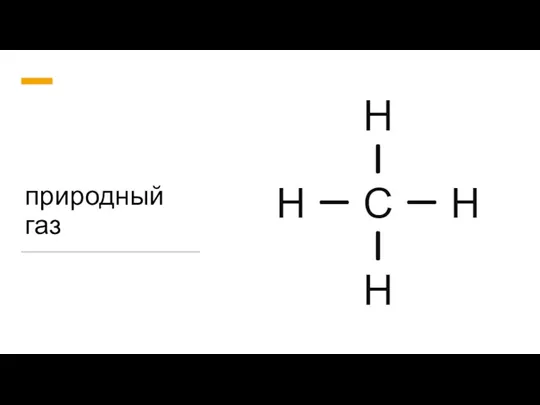 Природный газ
Природный газ Урок по химии в 10 классе на тему: «Жиры» 2008 год.
Урок по химии в 10 классе на тему: «Жиры» 2008 год. Вещество. Простые и сложные вещества
Вещество. Простые и сложные вещества Коррозия металла
Коррозия металла Алкены. Решение задач и упражнений
Алкены. Решение задач и упражнений Анализ свойств карбамидоформальдегидных смол
Анализ свойств карбамидоформальдегидных смол