Содержание
- 2. Скорость хим.реакции – это изменение концентрации реагентов или продуктов за единицу времени Факторы, влияющие на скорость
- 3. Природа веществ Чем более химически активными являются реагенты, тем выше будет скорость реакции Например, наиболее быстро
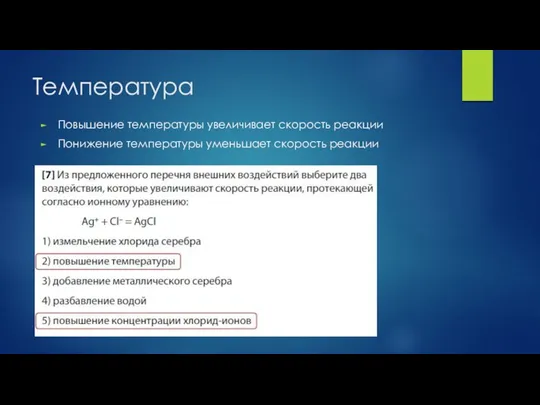
- 4. Температура Повышение температуры увеличивает скорость реакции Понижение температуры уменьшает скорость реакции
- 5. Катализатор Принимает участие в реакции, но сам не расходуется. Увеличивает скорость реакции(при условии, что для данной
- 6. Концентрация Влияет на скорость реакций с участием газов или жидкостей Повышение концентрации увеличивает скорость реакции Понижение
- 7. Давление Влияет на скорость реакций с участием газов Газы должны быть реагентами(что в продуктах – неважно)
- 8. Объем реакционной системы Увеличение объема=уменьшение давления Уменьшение объема = увеличение давления Добавление инертного газа – эффект
- 9. Степень измельчения (Площадь поверхности) Для реакций с участием твердых веществ Реакция идет на поверхности твердого вещества
- 10. Дополнения Перемешивание увеличивает скорость гетерогенных реакций Гомогенная реакция всегда идет быстрее, чем гетерогенная При комнатной температуре
- 11. Практика А-2 Б-3
- 12. Практика В-3 Г-4
- 13. Ответ: 15 Из предложенного перечня выберите схемы двух реакций, которые протекают при комнатной температуре с наибольшей
- 14. Ответ: 23 Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к увеличению скорости реакции
- 15. Ответ: 24 Из предложенного перечня выберите два воздействия, которые увеличат скорость гидрирования пропена: 1. Увеличение объема
- 16. Ответ: 24 Из предложенного набора факторов выберите два фактора, каждый из которых влияет как на скорость
- 17. Ответ: 25 Из предложенного перечня реакций выберите две реакции, скорость которых зависит как от концентрации кислоты,
- 18. Ответ: 43 Из предложенного перечня внешних воздействий выберите два воздействия, которые влияют на скорость реакции, протекающей
- 19. Ответ: 31 Из предложенного перечня воздействий выберите два воздействия, которые приведут к увеличению скорости экзотермической реакции
- 20. Ответ: 23 Выберите два фактора, от которых не зависит скорость растворения меди в азотной кислоте 1.
- 21. Ответ: 34 Из предложенного перечня выберите два воздействия, которые увеличивают скорость реакции обжига пирита: 1. добавление
- 22. Ответ: 42 Из предложенного перечня внешних воздействий выберите два воздействия, которые уменьшают скорость реакции CaCO3+2HCl=CaCl2+CO2+H2O Понижение
- 23. Задание 24 ЕГЭ Необратимые реакции – это реакции, в ходе которых хотя бы одно из исходных
- 24. Химическое равновесие В состоянии равновесия скорости прямой и обратной реакции равны между собой и не равны
- 25. Факторы, влияющие на смещение равновесия 1. Концентрация 2. Давление 3. Температура
- 26. Концентрация При увеличении концентрации реагентов равновесие смещается в сторону продуктов При увеличении концентрации продуктов равновесие смещается
- 27. Концентрация При уменьшении концентрации реагентов равновесие смещается в сторону реагентов При уменьшении концентрации продуктов равновесие смещается
- 28. Давление(только для реакций с участием газов) Считаем количество молекул газа слева и справа При повышении давления
- 29. Температура Повышение температуры смещает равновесие в сторону эндотермической реакции. В сторону –Q Понижение температуры смещает равновесие
- 30. Катализатор Катализатор не влияет на смещение равновесия Ускоряет и прямую, и обратную реакции одновременно
- 31. Добавление твердых веществ не влияет на равновесие Изменение площади пов-ти тв в-в Растворимость!
- 32. Вопрос о равновесии: смотрим и на реагенты, и на продукты, и на их агрегатное состояние Вопрос
- 33. Практика
- 34. Практика
- 35. Практика
- 36. Практика
- 37. Практика
- 38. Практика
- 39. Практика
- 40. Молярная концентрация с = n : V 2) По условию объем реактора не меняется 3) Тогда
- 44. Практика -36
- 46. Скачать презентацию










































 Сложные эфиры. Жиры
Сложные эфиры. Жиры Взаимодействие цинка с разбавленной соляной кислотой. Лабораторный опыт. Шаблон
Взаимодействие цинка с разбавленной соляной кислотой. Лабораторный опыт. Шаблон Получение азокрасителя в лабораторных условиях
Получение азокрасителя в лабораторных условиях Образование химических соединений с учетом валентности элементов
Образование химических соединений с учетом валентности элементов Презентация на тему Азот
Презентация на тему Азот  Nanofibers of aluminum oxide
Nanofibers of aluminum oxide Презентация на тему Углекислый газ
Презентация на тему Углекислый газ  Полистирол. Оформление мини-реферата по химии
Полистирол. Оформление мини-реферата по химии Опасная бытовая химия!
Опасная бытовая химия! Химическая организация природы
Химическая организация природы Кислород
Кислород Сследование коэффициентов переноса жидкостей в молекулярных моделях opls и saft
Сследование коэффициентов переноса жидкостей в молекулярных моделях opls и saft Три секрета прочности волокнистых композитов
Три секрета прочности волокнистых композитов Активность каталазы
Активность каталазы Оливины. Структура оливинов
Оливины. Структура оливинов Разбор ДЗ. Титрование – общие моменты
Разбор ДЗ. Титрование – общие моменты Аналитическая химия как наука. Лекция 1
Аналитическая химия как наука. Лекция 1 Перманганатометрия и комплексонометрия
Перманганатометрия и комплексонометрия Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс) Какую воду мы пьем
Какую воду мы пьем Кислоты
Кислоты Качественная реакция на многоатомные спирты
Качественная реакция на многоатомные спирты Электролитическая диссоциация
Электролитическая диссоциация Сказка о братьях карбонатах
Сказка о братьях карбонатах Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6
Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6 Природные источники углеводородов
Природные источники углеводородов Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Презентация на тему Многоатомные спирты
Презентация на тему Многоатомные спирты