Содержание
- 2. Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей
- 3. В живой природе: Входит в состав животных и растительных белков, витаминов, гормонов. СЕРА В ПРИРОДЕ Сера
- 4. СЕРА nº=16 p+=16 ē=16 Z=+16 Степени окисления серы: −2 (окислительные свойства); 0; +2, +4, +6 (восстановительные
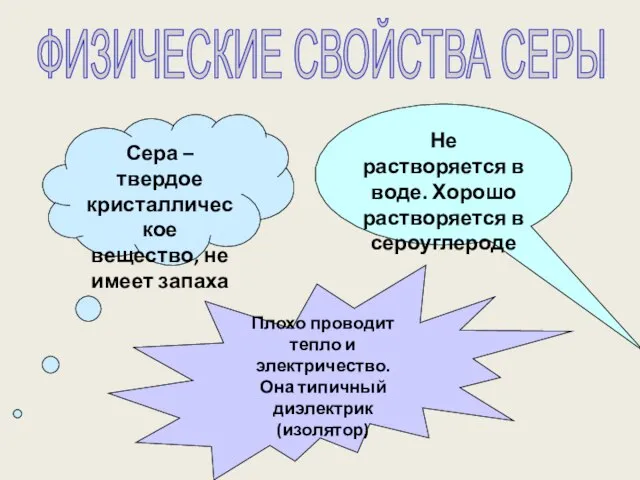
- 5. ФИЗИЧЕСКИЕ СВОЙСТВА СЕРЫ Сера – твердое кристаллическое вещество, не имеет запаха Не растворяется в воде. Хорошо
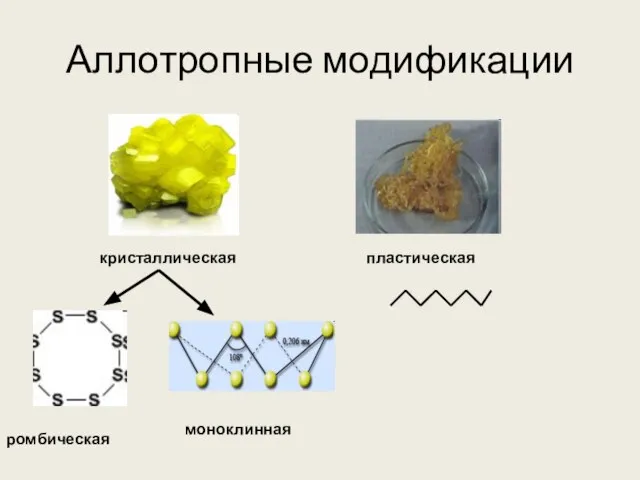
- 6. Аллотропные модификации кристаллическая пластическая ромбическая моноклинная
- 7. Кристаллическая, пластическая и моноклинная сера
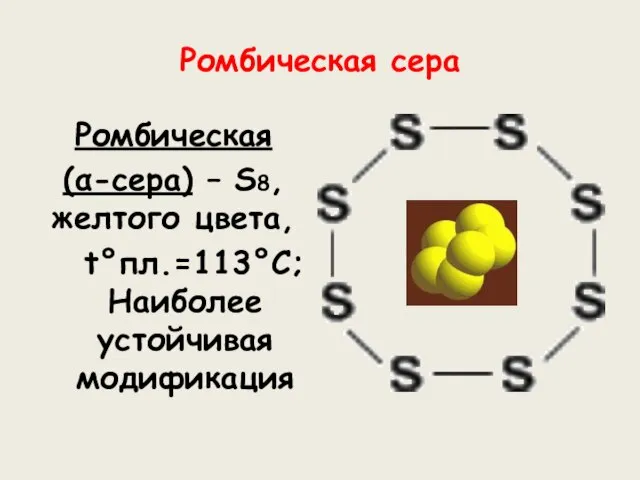
- 8. Ромбическая сера Ромбическая (α-сера) – S8, желтого цвета, t°пл.=113°C; Наиболее устойчивая модификация
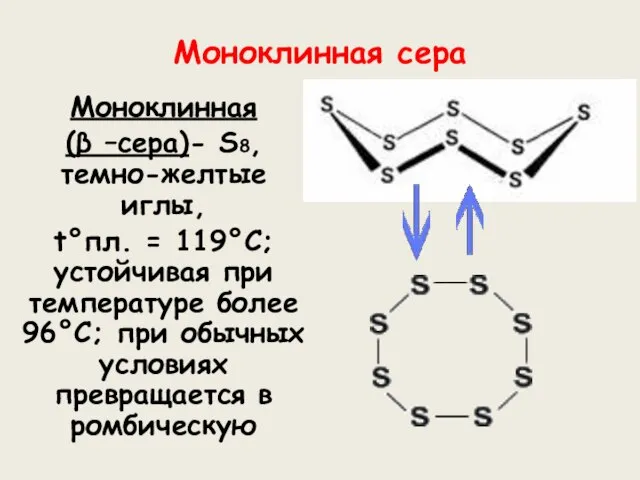
- 9. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые иглы, t°пл. = 119°C; устойчивая при температуре более 96°С;
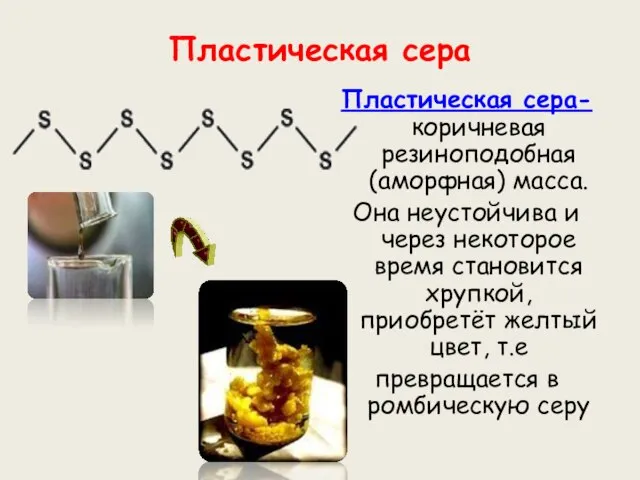
- 10. Пластическая сера Пластическая сера- коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой,
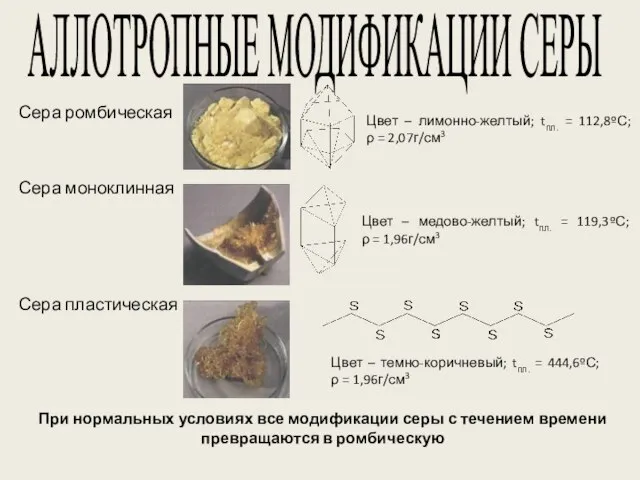
- 12. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ Сера ромбическая Сера пластическая Сера моноклинная Цвет – лимонно-желтый; tпл. = 112,8ºС; ρ
- 13. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ S Реагирует с металлами (искл. золото, платина и рутений): 2Na + S =
- 14. ПОЛУЧЕНИЕ СЕРЫ Неполное окисление сероводорода: 2H2S + O2 = 2S↓ + 2H2O (недостаток O2). 2. Реакция
- 15. Нахождение серы в природе Сера является на 16-м месте по распространённости в земной коре. Встречается в
- 16. Сера в природе Самородная Сульфидная: Сероводород H2S Цинковая обманка ZnS Киноварь HgS Свинцовый блеск PbS Пирит
- 17. Сера также встречается в виде сульфатов - солей серной кислоты - мирабилит
- 18. Пирит – «огненный камень» (соединение серы в природе)
- 19. Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера
- 20. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
- 21. S
- 23. Скачать презентацию













 Алкадиены. Закрепление пройденного материала
Алкадиены. Закрепление пройденного материала Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна
Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна Силумины. Виды силуминов
Силумины. Виды силуминов Рідкі кристали
Рідкі кристали Кислород
Кислород Скорость химических реакций
Скорость химических реакций Состояния вещества. Тест. 5 класс
Состояния вещества. Тест. 5 класс Горные породы
Горные породы Химическая связь
Химическая связь Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Презентация на тему Применение жиров
Презентация на тему Применение жиров  Открытие Менделеева Д. И
Открытие Менделеева Д. И Металлы и их соединения
Металлы и их соединения Серная кислота и её соли. Качественная реакция на сульфат-ион
Серная кислота и её соли. Качественная реакция на сульфат-ион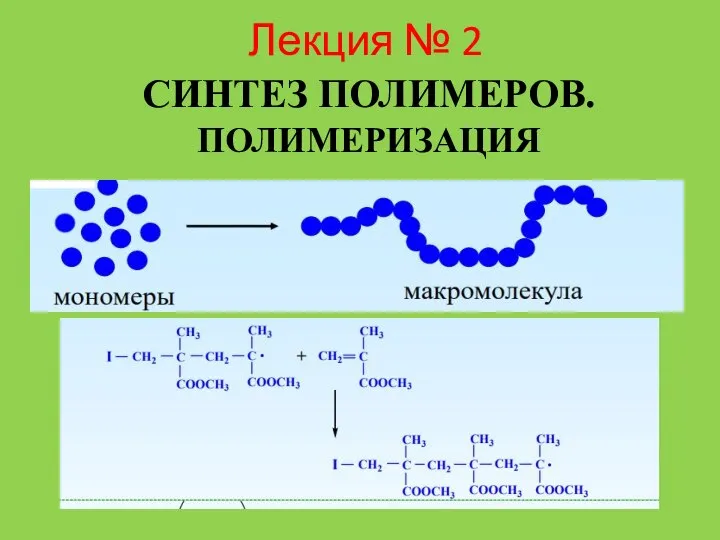 Лекция № 2. Синтез полимеров. Полимеризация
Лекция № 2. Синтез полимеров. Полимеризация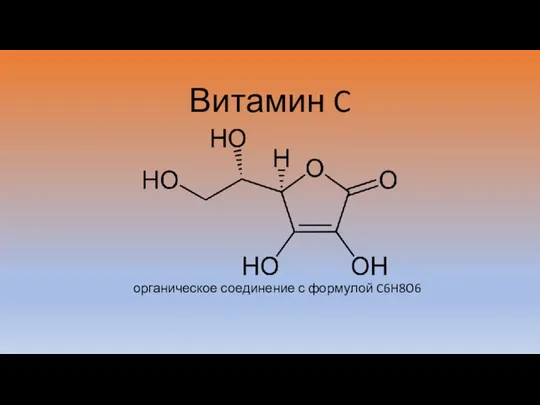 Витамин C
Витамин C Презентация на тему Азотная кислота и ее соли (9 класс)
Презентация на тему Азотная кислота и ее соли (9 класс)  Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования:
Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования: Растворы. Процесс растворения (2)
Растворы. Процесс растворения (2) Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Цикл Кребса
Цикл Кребса Михаил Васильевич Ломоносов (1711-1765)
Михаил Васильевич Ломоносов (1711-1765) Общие способы получения металлов
Общие способы получения металлов Особенности органических веществ
Особенности органических веществ Химический состав клетки
Химический состав клетки