Содержание
Слайд 9Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе
Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе

которых тепло поглощается, или, наоборот, тепло выделяется.
Экзотермические реакции (греч. exo - вне) - химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят "+ Q" (Q - тепло), иногда бывает указано точное количество выделяющегося тепла. Например: 2Mg + O2 = 2MgO + Q
Эндотермические реакции(греч. ἔνδον - внутри) - химические реакции, сопровождающиеся поглощением тепла, в результате которых образуются вещества с более высоким энергетическим уровнем (их внутренняя энергия увеличивается).К таким реакциям наиболее часто относятся реакции разложения. При написании эндотермических реакций в конце ставят "-Q", либо указывают точное количество поглощенной энергии. Примеры таких реакций: 2HgO = Hg + O2 - Q
Экзотермические реакции (греч. exo - вне) - химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят "+ Q" (Q - тепло), иногда бывает указано точное количество выделяющегося тепла. Например: 2Mg + O2 = 2MgO + Q
Эндотермические реакции(греч. ἔνδον - внутри) - химические реакции, сопровождающиеся поглощением тепла, в результате которых образуются вещества с более высоким энергетическим уровнем (их внутренняя энергия увеличивается).К таким реакциям наиболее часто относятся реакции разложения. При написании эндотермических реакций в конце ставят "-Q", либо указывают точное количество поглощенной энергии. Примеры таких реакций: 2HgO = Hg + O2 - Q
- Предыдущая
Портфолио студентки группы Э-32 Гулой МаргаритыСледующая -
Фотоальбом Природа вокруг нас

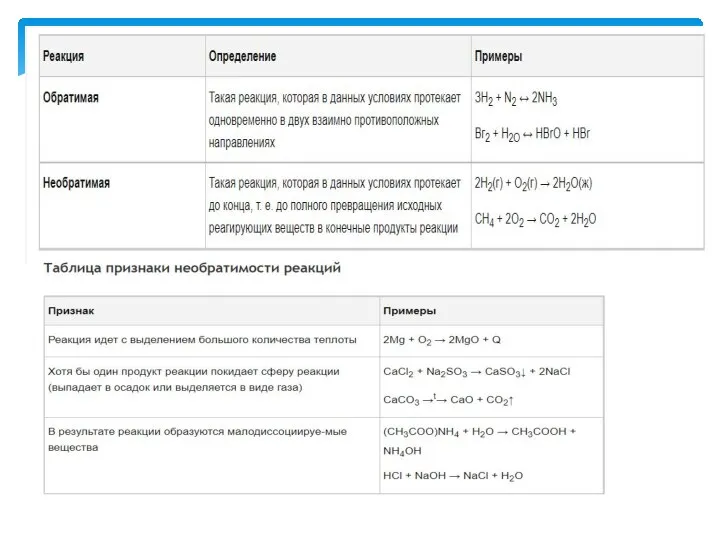
 Генетические ряды углеводородов. Обобщение и систематизация знаний
Генетические ряды углеводородов. Обобщение и систематизация знаний Признаки химических реакций
Признаки химических реакций Фосфор в организме человека
Фосфор в организме человека Презентация по Химии "Алмаз и графит"
Презентация по Химии "Алмаз и графит"  Алкадиены
Алкадиены Современные представления о строении атома
Современные представления о строении атома Алкины. Химия с элементами биологии
Алкины. Химия с элементами биологии pervonachalnye_svedenia_ob_org_v-kh
pervonachalnye_svedenia_ob_org_v-kh Каучук, резина
Каучук, резина Неорганические молекулы живого вещества: вода; химические свойства и биологическая роль
Неорганические молекулы живого вещества: вода; химические свойства и биологическая роль Տերպենոիդներ (Իզոպրենոիդներ) պարունակող դեղաբույսեր եվ հումք
Տերպենոիդներ (Իզոպրենոիդներ) պարունակող դեղաբույսեր եվ հումք Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты a319f492a6071afff03d7efc722c906b
a319f492a6071afff03d7efc722c906b Знакомство с химией
Знакомство с химией Horenie
Horenie Конструкционные и специальные материалы холодильной техники
Конструкционные и специальные материалы холодильной техники Степень окисления
Степень окисления Неметаллы IV-VI групп
Неметаллы IV-VI групп Аметист
Аметист Презентация на тему Неорганические полимеры
Презентация на тему Неорганические полимеры  Диффузия в газах, жидкостях и твердых телах
Диффузия в газах, жидкостях и твердых телах Задачи химической кинетики
Задачи химической кинетики Стан електронів у атомі
Стан електронів у атомі Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9
Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9 Валентность
Валентность Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов Теория электролитической диссоциации
Теория электролитической диссоциации Основные понятия и законы химии
Основные понятия и законы химии