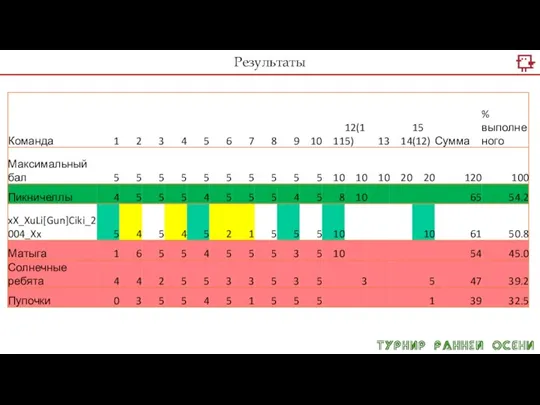
Слайд 4Решение задач Турнира
При диссоциации какого вещества образуется наибольшее количество анионов? Количество

всех веществ 0.8 моль. Для правильного ответа, напишите уравнения диссоциации в молекулярном и в ионном виде.
1) сульфата натрия
2) гидрокарбоната калия
3) хлорида алюминия
4) сульфата меди(II)
Слайд 5Решение задач Турнира
Задача 2 (5). Как много сульфат-ионов можно получить при

полной диссоциации 0.6 сульфата алюминия? Напишите уравнения как молекулярное, так и ионное.
Слайд 6Решение задач Турнира
Задача 3 (5). В растворе есть хлорид железа(III) и

0,1 моль хлороводорода. В растворе в общем находится 0,7 моль хлорид-ионов. Чему равно количество хлорида железа(III)?
Хлорида железа – 0.2 моль.
Слайд 7Решение задач Турнира
Задача 4 (5). Какой ион имеет наименьшую концентрацию в

водном растворе ортофосфорной кислоты?
PO43- - фосфат ион
Слайд 8Решение задач Турнира
Задача 5 (5). При диссоциации некоторого количества соли образовалось

1,5 моль катионов и 0,5 моль анионов. Какая это соль? Подтвердите уравнением диссоциации.
Слайд 9Решение задач Турнира
Задача 6 (5). Какой объем занимают (при н.у.) 400

кг азота?
400*1000/24*22.4 = 320000 л
Слайд 10Решение задач Турнира
Задача 7 (5). А сколько в молях воздуха должно

быть, чтобы содержать 400кг азота?
Массовая доля азота – 75.5
Масса воздуха 400*1000/0.755 = 533333.3 г
Молей воздух (29 г/моль) = 533333.3/29 = 18390.8 моль
Слайд 11Решение задач Турнира
Задача 8 (5). Сколько в граммах нужно взять сахара

и воды, чтобы получилось 200г раствора с 10% содержания сахара?
Эм, это вообще нужно пояснять?
Слайд 12Решение задач Турнира
Задача 9 (5). Напишите реакцию между оксидом калия и

фосфорной кислотой в молекулярном и ионном виде.
Слайд 13Решение задач Турнира
Задача 10 (5). В пробирку с раствором соли Х

добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение осадка. Выберите вещества X и Y, которые могут вступать в описанную реакцию.
Слайд 14Решение задач Турнира
Задача 11 (10). Приведите пример молекулярного уравнения, описывающего реакцию

иона серебра с гидроксид-ионом.
(задача не просто так стоит 10 баллов).
Ag+ + OH-= Ag2O + H2O
Слайд 15Решение задач Турнира
Задача 15 (10). Минерал пирит (FeS2) может гореть без

доступа воздуха, если его смешать с нитратом калия (KNO3). Напишите уравнение реакции горения, если известно, что смесь прореагировала полностью, а продукты сгорания: сульфит калия, сернистый газ, оксид железа (III) и азот. Сколько % по массе пирита содержит стехиометрическая смесь?
10FeS2 + 22KNO3 = 11K2SO3 + 9SO2 + 5Fe2O3 + 11N2
MFeS2 = 56 + 32*2 = 120 г/моль
MKNO3= 39 + 14 +16*3 = 101 г/моль
10*120/ (10*120+22*101) = 1200/3422 = 35.1%
Слайд 16Решение задач Турнира
Задача 13 (10). Элемент Х представлен в природе единственным

стабильным изотопом, который образуется при радиоактивном распаде каждого из двух ближайших соседей Х по таблице. Простое вещество Х – легкий , легкоплавкий металл. Он образует с кислородом несколько соединений. В соединениях ХаОб и ХбОа массовая доля металла равна 80,6% и 94,3% соответственно.
Cs!
Слайд 17Решение задач Турнира
Задача 14 (20). Три гидроксида – А, Б, В

– имеют одинаковую молярную массу. Гидроксид А при стандартных условиях – твердое нерастворимое в воде вещество. Гидроксид Б – жидкость, В – твердое вещество, оба неограниченно смешиваются с водой.
Массовая доля кислорода в соединениях Б и В одинаковая и составляет 65, 31%. Тогда как в А массовая доля равна 32, 65%. Гидроксид А вступает в реакции нейтрализации как с веществом Б, так и с веществом В. Водные растворы гидроксидов Б и В друг с другом не взаимодействуют.
Cu(OH)2
H2SO4
H3PO4















 Аминоксилоты. Общая формула аминокислот
Аминоксилоты. Общая формула аминокислот Характеристика кислорода и серы
Характеристика кислорода и серы Презентация в 8 классе к уроку по химии на тему__
Презентация в 8 классе к уроку по химии на тему__ Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Обобщение свойств углеводородов
Обобщение свойств углеводородов user_file_562b6f7f7ae4e
user_file_562b6f7f7ae4e Мезомерный эффект
Мезомерный эффект Теоретические основы органической химии
Теоретические основы органической химии Презентация на тему Молярный объем
Презентация на тему Молярный объем  Изучение пенопласта
Изучение пенопласта Электролитическая диссоциация. Устойчивость комплексных соединений
Электролитическая диссоциация. Устойчивость комплексных соединений Кислоты, соли
Кислоты, соли Презентация по Химии "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»"
Презентация по Химии "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»"  Свойства аренов
Свойства аренов Углеводороды
Углеводороды Презентация на тему Водород (9 класс)
Презентация на тему Водород (9 класс)  Способы получения металлов
Способы получения металлов Хром. Элемент vi группы
Хром. Элемент vi группы Контрольная работа №1
Контрольная работа №1 Алюминий
Алюминий Кислород. Нахождение в природе. Свойства. 8 класс
Кислород. Нахождение в природе. Свойства. 8 класс Стехиометрические законы химии
Стехиометрические законы химии Классификация неорганических веществ
Классификация неорганических веществ Обратимые и необратимые химические реакции. Химическое равновесие
Обратимые и необратимые химические реакции. Химическое равновесие Неметаллические материалы
Неметаллические материалы Предмет органической химии. Особенности органических веществ
Предмет органической химии. Особенности органических веществ Лекция 10. Неорганическая химия. Сероводород
Лекция 10. Неорганическая химия. Сероводород Синтез латексов
Синтез латексов