Слайд 2ДИСОЦІАЦІЯ ВОДИ
ВОДА НАЛЕЖИТЬ ДО ДУЖЕ СЛАБКИХ ЕЛЕКТРОЛІТІВ.
КІЛЬКІСТЬ МОЛЕКУЛ, ЩО ДИСОЦІЮЮТЬ

НА ЙОНИ, МІЗЕРНА.
РІВНЯННЯ ДИСОЦІАЦІЇ ВОДИ СПРОЩЕНО (БЕЗ ЗАПИСУ УТВОРЕНОГО КАТІОНА ГІДРОКСОНІЮ Н3О+) МАЄ ТАКИЙ ВИГЛЯД:
Н2О Н+ + ОН–
Слайд 5КІЛЬКІСНА ХАРАКТЕРИСТИКА СЕРЕДОВИЩА

Слайд 6ВЗАЄМОЗВ’ЯЗОК МІЖ ВМІСТОМ ЙОНІВ У РОЗЧИНІ ТА ЗНАЧЕННЯМ PH
МОЖНА ПРОСЛІДКУВАТИ ЗА ТАКОЮ

СХЕМОЮ:
Слайд 7СПІВВІДНОШЕННЯ МІЖ ВМІСТОМ Н+ ТА ОН-

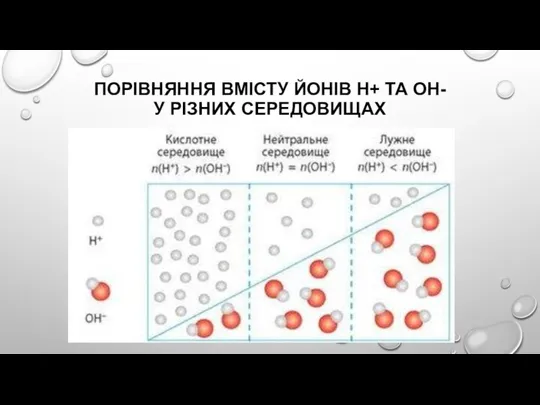
Слайд 8ПОРІВНЯННЯ ВМІСТУ ЙОНІВ Н+ ТА ОН-
У РІЗНИХ СЕРЕДОВИЩАХ
Слайд 9РН - МЕТРИ:
1. СТАЦІОНАРНИЙ; 2. ПОРТАТИВНИЙ

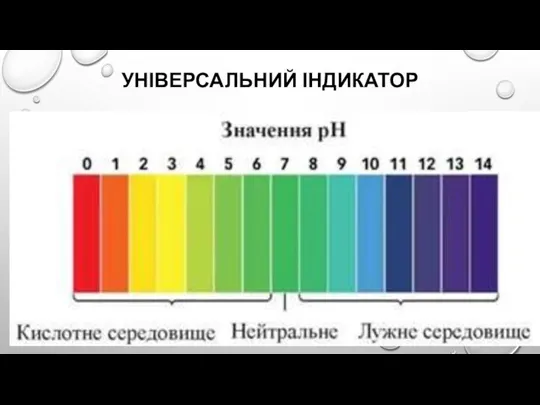
Слайд 11ІНДИКАТОРИ ЗМІНЮЮТЬ СВОЄ ЗАБАРВЛЕННЯ В МАЛОМУ ІНТЕРВАЛІ РН, ЯКИЙ НАЗИВАЮТЬ
ІНТЕРВАЛОМ ПЕРЕХОДУ

РН:
Слайд 13ЗАБАРВЛЕННЯ
ІНДИКАТОРІВ У РІДИНАХ З
РІЗНИМ ЗНАЧЕННЯМ PH

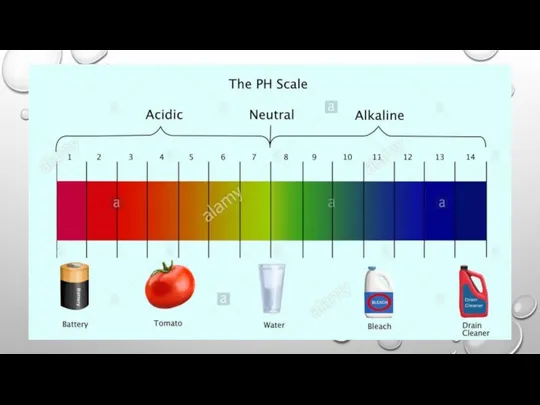
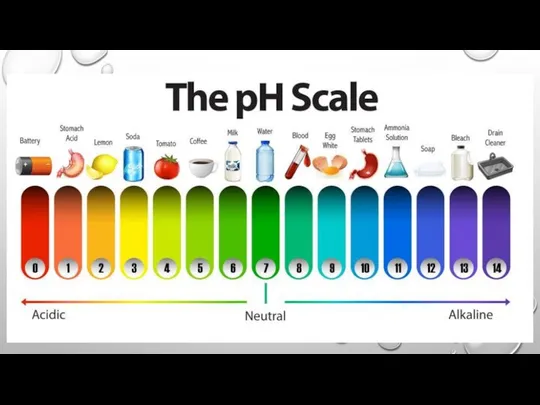
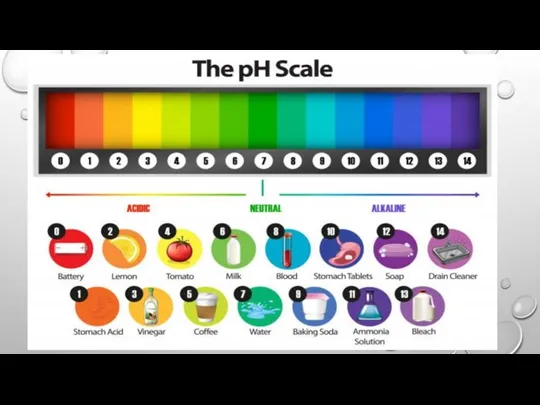
Слайд 15ЗНАЧЕННЯ КИСЛОТНОСТІ РОЗЧИНІВ ДЕЯКИХ РЕЧОВИН І ПРИРОДНИХ РІДИН

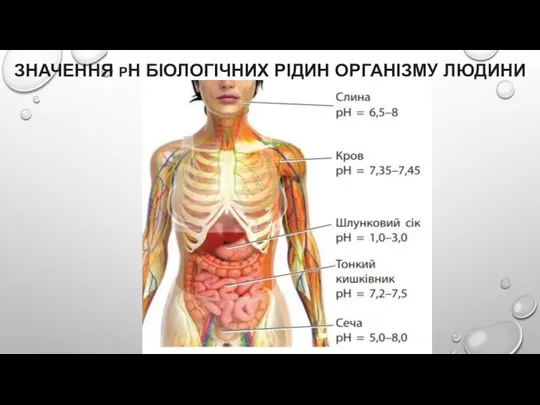
Слайд 16ЗНАЧЕННЯ PH БІОЛОГІЧНИХ РІДИН ОРГАНІЗМУ ЛЮДИНИ
Слайд 17СЕРЕДНІ ЗНАЧЕННЯ ВОДНЕВОГО ПОКАЗНИКА ДЛЯ ДЕЯКИХ РІДИН

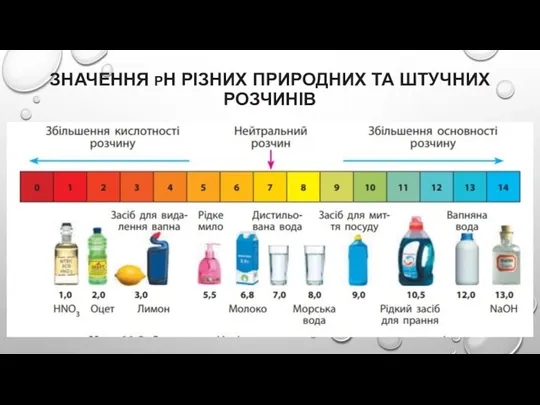
Слайд 18ЗНАЧЕННЯ РН РІЗНИХ ПРИРОДНИХ ТА ШТУЧНИХ РОЗЧИНІВ
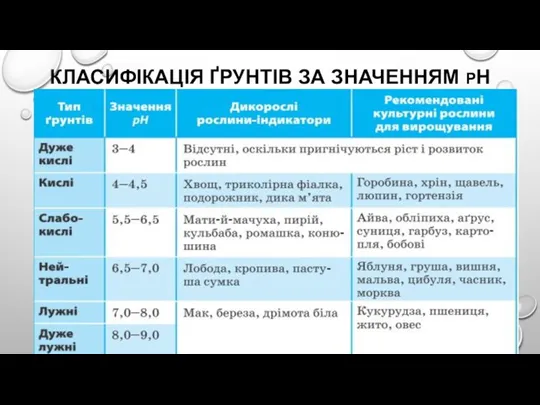
Слайд 22КЛАСИФІКАЦІЯ ҐРУНТІВ ЗА ЗНАЧЕННЯМ РН
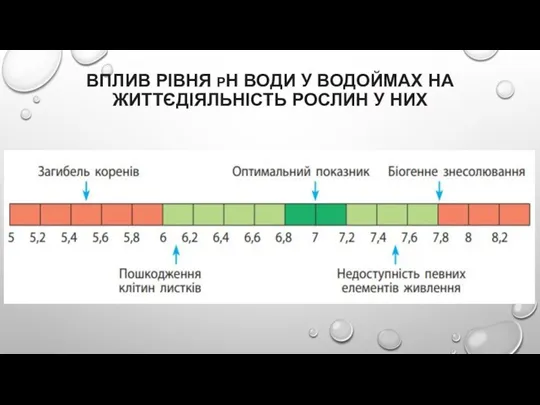
Слайд 23ВПЛИВ РІВНЯ PH ВОДИ У ВОДОЙМАХ НА ЖИТТЄДІЯЛЬНІСТЬ РОСЛИН У НИХ


















 Презентация на тему Полисахариды
Презентация на тему Полисахариды  Дисахариды и полисахариды
Дисахариды и полисахариды Предельные углеводороды - алканы
Предельные углеводороды - алканы Элемент первой группы, калий
Элемент первой группы, калий Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас Предмет химии, простые и сложные вещества
Предмет химии, простые и сложные вещества Значение химии в медицине
Значение химии в медицине Промышленный биокатализ
Промышленный биокатализ Контрольна робота, хімія
Контрольна робота, хімія Водород. История открытия
Водород. История открытия Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Оксиды
Оксиды Синтетические моющие средства (СМС). Наша стирка по-байкальски
Синтетические моющие средства (СМС). Наша стирка по-байкальски География. Уральские самоцветы
География. Уральские самоцветы Термохимия. Задания
Термохимия. Задания Čo sú chemické reakcie
Čo sú chemické reakcie Амины
Амины Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6
Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6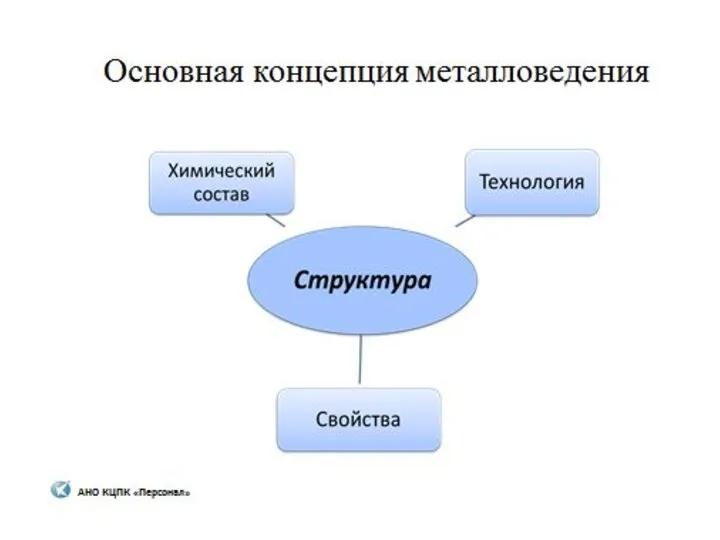 Металловедение
Металловедение Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы Серная кислота
Серная кислота Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Галогеноалканы: получение, свойства и применение
Галогеноалканы: получение, свойства и применение Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Электроотрицательность (ЭО)
Электроотрицательность (ЭО) Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю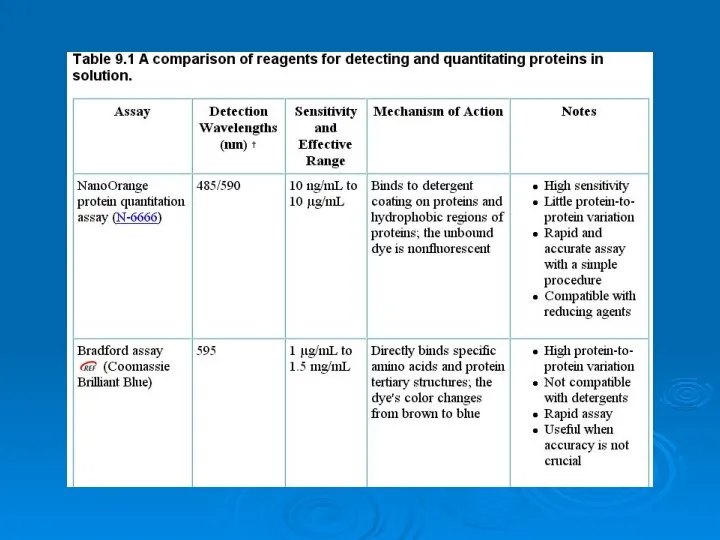 Analysis of proteins
Analysis of proteins Физические механизмы образования кристаллов
Физические механизмы образования кристаллов