— число фаз (например, агрегатное состояние), с — число степеней свободы, k — компоненты системы (примеры: H2O, CO2), n — число параметров, определяющих равновесное состояние системы
При переменном давлении (т. е. для жидкостей и газов, т. к. изменение давления на состояние твёрдого тела практически не влияет) правило фаз сводится к выражению:
ф + с = k + 2.
В случае однокомпонентной системы оно упрощается до:
ф + с = 3, что значит, что в однокомпонентной системе при заданном давлении и температуре могут сосуществовать три фазы. На фазовой диаграмме это соответствует тройной точке.
При изменении либо давления, либо температуры могут сосуществовать две фазы и вторая переменная зависима, что соответствует линии. Если фаза одна, то число степеней системы равно двум, и температура и давление могут меняться до тех пор, пока система не окажется на одной из ограничивающих область линий.
Правило фаз Гиббса










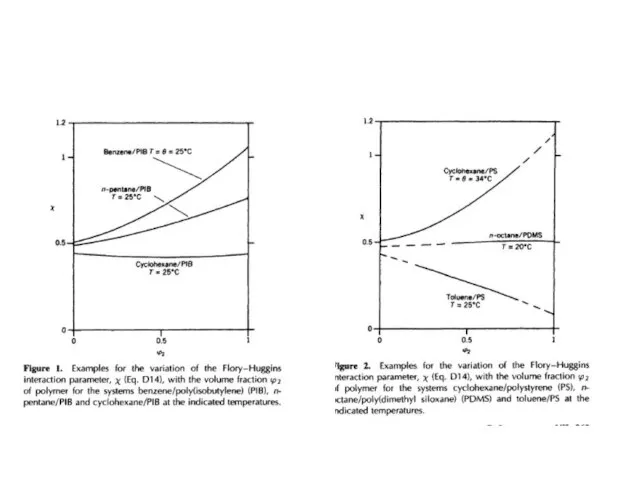



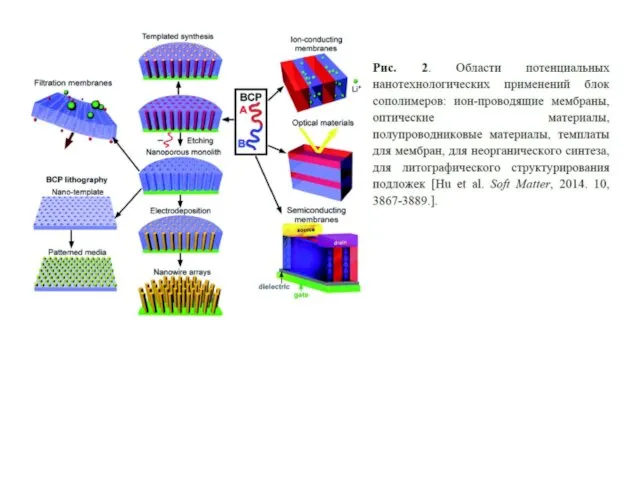
 Нефть
Нефть Химия. Вопросы. Практическая работа
Химия. Вопросы. Практическая работа Ковалентная химическая связь
Ковалентная химическая связь Первый закон термодинамики. Термохимия
Первый закон термодинамики. Термохимия Процессы растворения твёрдых веществ
Процессы растворения твёрдых веществ кислородосодерж. орг. соед. (1)
кислородосодерж. орг. соед. (1) Лекция 1
Лекция 1 Стерилизация технологических потоков и оборудования
Стерилизация технологических потоков и оборудования Модели молекул
Модели молекул Физические свойства алкенов
Физические свойства алкенов Нуклеинови киселини
Нуклеинови киселини Алифатические соединения. Тема № 6
Алифатические соединения. Тема № 6 Типы химических реакций
Типы химических реакций Галогены элементы VII – А группы
Галогены элементы VII – А группы Презентация на тему Изомерия алкенов
Презентация на тему Изомерия алкенов  Кислородсодержащие органические вещества
Кислородсодержащие органические вещества Окислительно-восстановительные реакции. Степень окисления
Окислительно-восстановительные реакции. Степень окисления 01. Химический состав
01. Химический состав Материаловедение
Материаловедение Исследование влияния изменения технических параметров на производительность установки замедленного коксования
Исследование влияния изменения технических параметров на производительность установки замедленного коксования Увлекательный мир науки и практики
Увлекательный мир науки и практики Молекулярная струйная печать
Молекулярная струйная печать Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот
Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот Свойства и применение серы
Свойства и применение серы Электролиз
Электролиз Новогодний Пробник №190415
Новогодний Пробник №190415 Пидорасня
Пидорасня Презентация на тему Минеральные вещества
Презентация на тему Минеральные вещества