Содержание
- 2. • é – это частица! m0=0,9109534*10 -27 г Z=1,6021892*10 -19 Кл
- 3. é – волна! Электрон обладает большой СКОРОСТЬЮ и ЭНЕРГИЕЙ! За долю секунды электрон способен «обежать» целую
- 4. Местоположение электронов в пространстве в данный момент времени определить невозможно. Они ведут себя примерно так, как
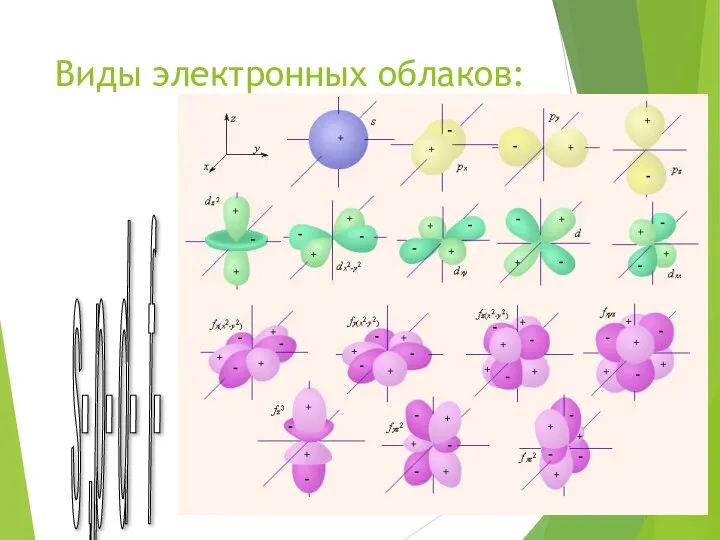
- 5. Виды электронных облаков: s-,p- d- f-
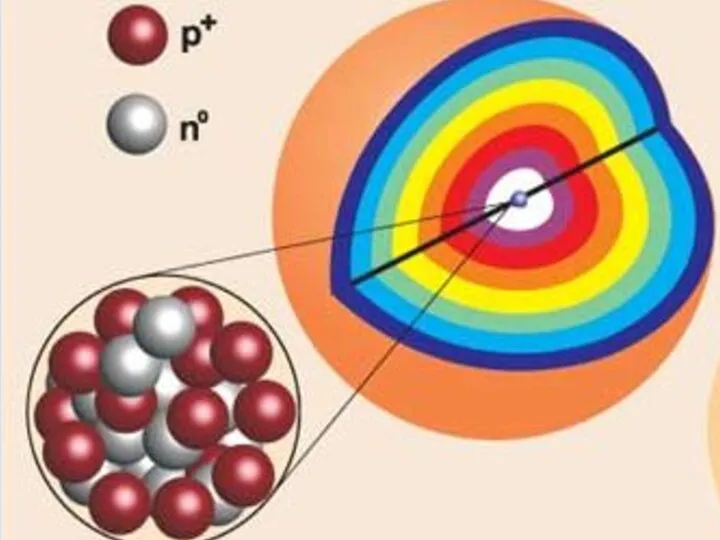
- 6. Все электроны атома образуют его ЭЛЕКТРОННУЮ ОБОЛОЧКУ
- 7. ЭЛЕКТРОННАЯ ОБОЛОЧКА ДЕЛИТСЯ НА УРОВНИ СЛОИ ИЗВЕСТНО 7 ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ, РАСПОЛОЖЕННЫХ НА РАЗНЫХ РАССТОЯНИЯХ ОТ ЯДРА
- 9. УРОВНИ состоят из ПОДУРОВНЕЙ, на которых располагаются атомные орбитали s-, p-, d- и f-типа
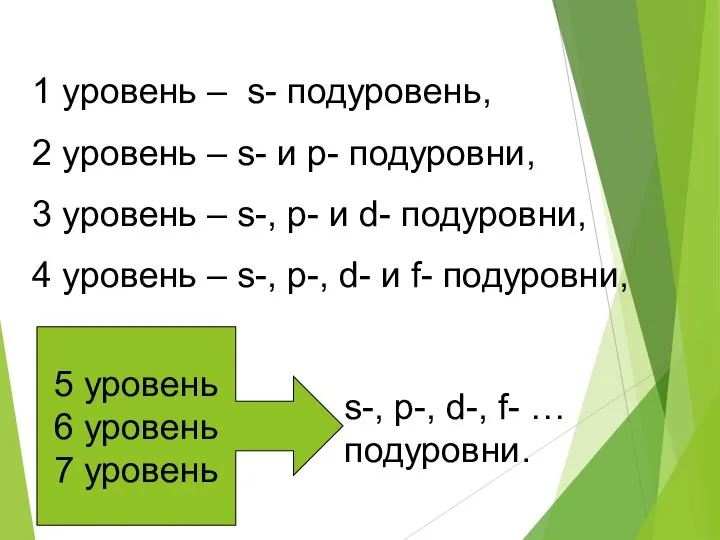
- 10. 1 уровень – s- подуровень, 2 уровень – s- и p- подуровни, 3 уровень – s-,
- 11. s-подуровень 1 АО р-подуровень 3 АО d-подуровень 5 АО f-подуровень 7 АО ИТАК, имеем 1s2s2p3s3p3d4s4p4d4f5s5p5d5f… 6s6p6d6f…7s7p7d7f…
- 12. ПРАВИЛА ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ АО, ПОДУРОВНЕЙ, УРОВНЕЙ 1) На одной АО могут находиться только ДВА электрона, которые
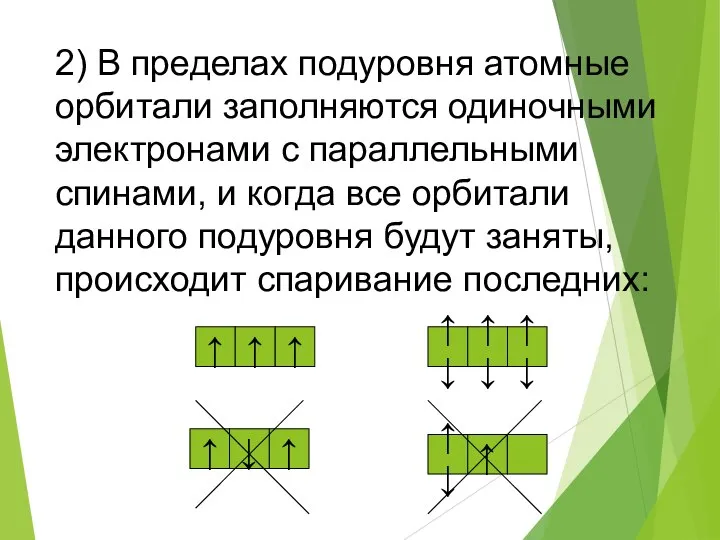
- 13. 2) В пределах подуровня атомные орбитали заполняются одиночными электронами с параллельными спинами, и когда все орбитали
- 14. 3) Электроны стремятся занять энергетически выгодное положение в электронной оболочке, руководствуясь правилом наименьшей энергии расположим АО
- 15. Σ 1 2 3 3 4 5 4 5 6 7 5 6 7 8 1s2s2p3s3p3d4s4p4d4f5s5p5d5f…
- 16. СХЕМА СТРОЕНИЯ АТОМА Н +1 Показывает распределение электронов по уровням 1
- 17. ЭЛЕКТРОННАЯ ФОРМУЛА (КОНФИГУРАЦИЯ) АТОМА 1s1 Показывает распределение электронов по подуровням
- 19. Скачать презентацию












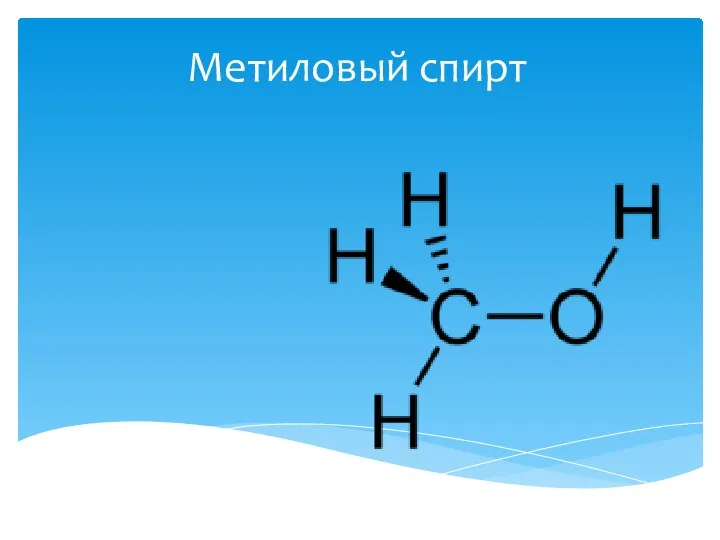 Метиловый спирт
Метиловый спирт Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6
Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6 Техника титрования и лабораторная посуда
Техника титрования и лабораторная посуда Гибридизация
Гибридизация Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу
Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов Общая характеристика оксидов
Общая характеристика оксидов Алкадиены. Каучук. История открытия каучука
Алкадиены. Каучук. История открытия каучука Нихром. Физические свойства
Нихром. Физические свойства Алкадиены: номенклатуры, изомерия. Тест
Алкадиены: номенклатуры, изомерия. Тест Щелочно-земельные металлы и магний
Щелочно-земельные металлы и магний Характеристика кислорода как химического элемента и простого вещества
Характеристика кислорода как химического элемента и простого вещества Свойства химической связи
Свойства химической связи Л1.4. Диаграмма железо-углерод
Л1.4. Диаграмма железо-углерод Презентация на тему Ковалентная неполярная связь
Презентация на тему Ковалентная неполярная связь  Презентация на тему Этиловый спирт и его влияние на здоровье человека
Презентация на тему Этиловый спирт и его влияние на здоровье человека  Алканы: гомологический ряд, строение, номенклатура, физические свойства
Алканы: гомологический ряд, строение, номенклатура, физические свойства Порядок в жидкостях
Порядок в жидкостях Молярная масса вещества
Молярная масса вещества Презентация на тему Общая жесткость воды
Презентация на тему Общая жесткость воды  Химические свойства оснований
Химические свойства оснований День химии
День химии Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем
Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем Вывод и обсуждение
Вывод и обсуждение Кристаллические решетки
Кристаллические решетки Углеводы: моно-, олиго- и полисахариды
Углеводы: моно-, олиго- и полисахариды Презентация на тему Химическая связь (8 класс)
Презентация на тему Химическая связь (8 класс)  Химический футбол на тему: Химия вокруг нас
Химический футбол на тему: Химия вокруг нас