Содержание
- 2. ЦЕЛИ: развивать навыки практического использования приобретенных знаний и умений в практической деятельности и повседневной жизни; формировать
- 3. ЗАДАЧИ расширение и углубление знаний по теме ; Развитие интереса у учащихся по предмету; Повышение уровня
- 4. Интеллектуальный марафон: приветствие команд Мы с химией уже знакомы, Ее мы учим второй год, Но знаем
- 5. Разминка: узнай вещество Это что за вещество? С лакмусом красит оно На рукав пролил-дыра, что же
- 6. Игра со зрителями: кислотный дождь отгадать названия кислот, зашифрованные в женских именах. (Ф......ая, .Зо...я, ..Р.ая, .Оля...,
- 7. Ответ Фосфорная Азотная Серная Соляная Кремниевая
- 8. ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки Попавшие на кожу капли раствора кислоты
- 9. Правила техники безопасности Налил я воду в кислоту, Вдруг брызги, брызги – все в аду! Теперь
- 10. По какому признаку кислоты разделены на группы? HF HCl HBr HI HNO3 HClO4 H2S H2SO4 H2SO3
- 11. Одноосновные HCl, HNO3 Двухосновные H2SO4,H2SiO3 Трехосновные H3PO4 Кислоты разделены на группы по числу атомов водорода(основность). Кислоты
- 12. Конкурс эрудитов 1 команда Составить формулы кислот: H, PO4, S,H3, Ca, CO2, CO3, H2, Cl, SiO3,
- 13. ПРОВЕРЬ СВОИ ЗНАНИЯ H3PO4 HCl H2S H2CO3 H3BO3 H2SiO3 H2SO3 HBr HF HNO3 H2SO4 HNO2 Индикатор
- 14. Выполнить действия 1.Формула кислоты это: а) NaOH б) HCL в) CuCL2 г) SO3 2. Кислота, применяющаяся
- 15. ПРОВЕРЬ СВОИ ЗНАНИЯ 1б 2б 3в 4в 5б 1б 2г 3в 4б 5б
- 16. Химический эксперимент BaCl2 + H2SO4 = NaOH + H2SO4 = Mg + H2So4 = AgNO3 +
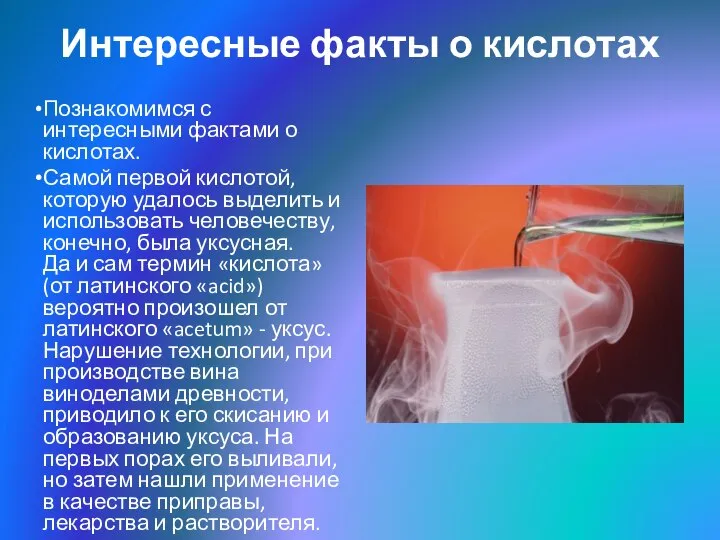
- 17. Интересные факты о кислотах Познакомимся с интересными фактами о кислотах. Самой первой кислотой, которую удалось выделить
- 18. Венец первооткрывателя серной кислоты в 10 веке примерил персидский химик Абубекер-Аль- Рези. В России долгое время
- 19. Важным ингредиентом популярной Кока-колы является «средняя» ортофосфорная кислота. К слабым кислотам относятся борная (необходима для изготовления
- 21. Скачать презентацию

















 Строение и физические свойства металлов
Строение и физические свойства металлов Биологическая роль III(A) группы
Биологическая роль III(A) группы Валентность. Что же это такое?
Валентность. Что же это такое?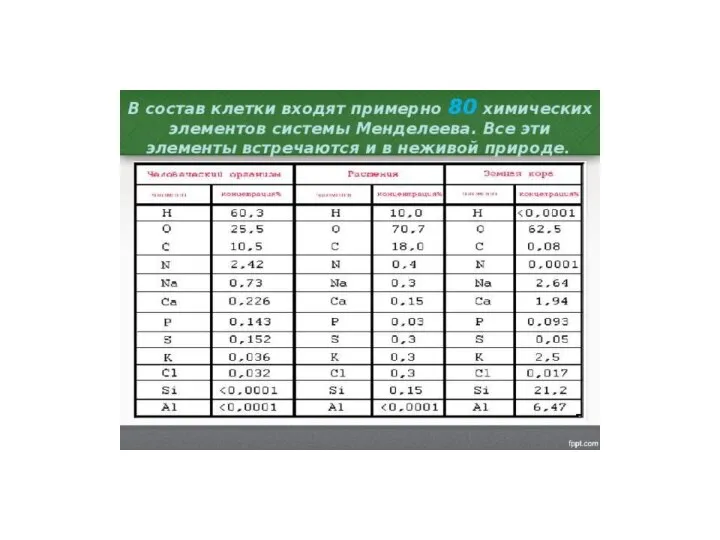 Состав клетки
Состав клетки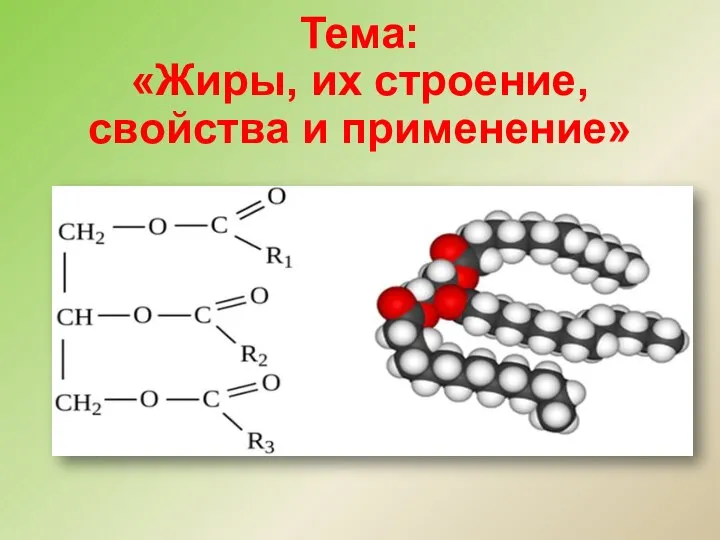 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Изучение свойств анилина. Лабораторная работа №18
Изучение свойств анилина. Лабораторная работа №18 Разнообразие жизни на Земле - Презентация_
Разнообразие жизни на Земле - Презентация_ Продолжение истории: 1933 год, Ленинград (Питер)
Продолжение истории: 1933 год, Ленинград (Питер) Смеси: гетерогенные, гомогенные
Смеси: гетерогенные, гомогенные Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Степень окисления
Степень окисления Основы химии полимеров
Основы химии полимеров Тренажер. Химические свойства солей
Тренажер. Химические свойства солей Презентация на тему Мыло. Синтетические моющие средства
Презентация на тему Мыло. Синтетические моющие средства  Строение и свойства циклоалканов
Строение и свойства циклоалканов Биодизельное топливо
Биодизельное топливо Соли: классификация, получение, номенклатура
Соли: классификация, получение, номенклатура Классификация химических реакций
Классификация химических реакций Средства для мытья окон
Средства для мытья окон Алхимики в Средние века
Алхимики в Средние века Алканы. Химические свойства. Применение
Алканы. Химические свойства. Применение Многоатомные спирты
Многоатомные спирты Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов proekt_TTU_15 (1)
proekt_TTU_15 (1) Атомы. Нахождение в природе
Атомы. Нахождение в природе Кремний и его соединения
Кремний и его соединения