Содержание
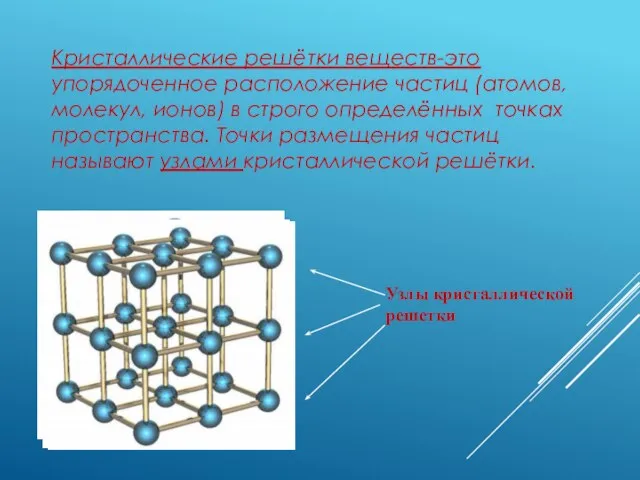
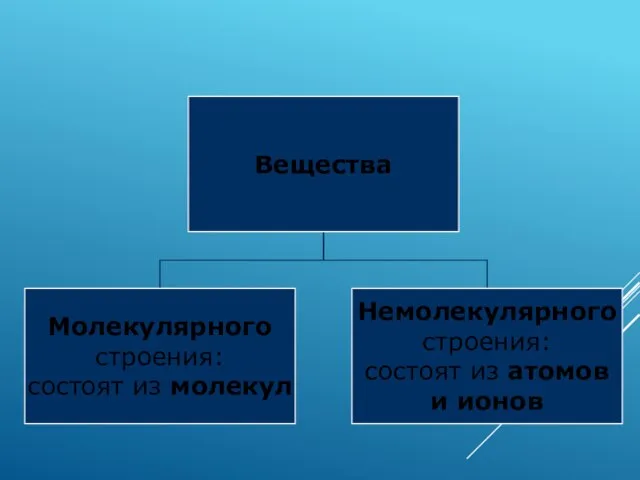
- 2. Кристаллические решётки веществ-это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения
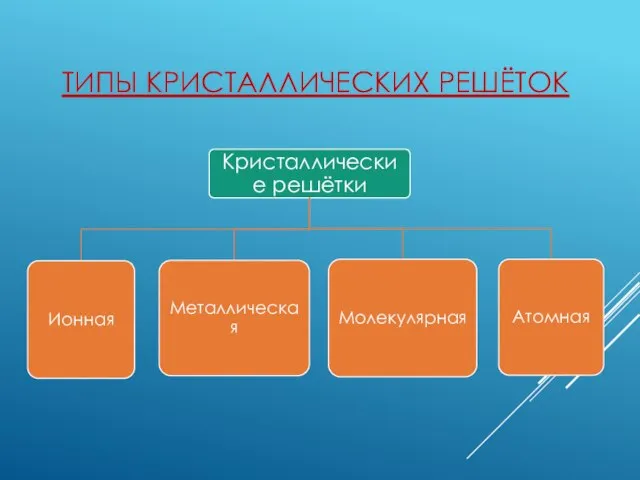
- 3. ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
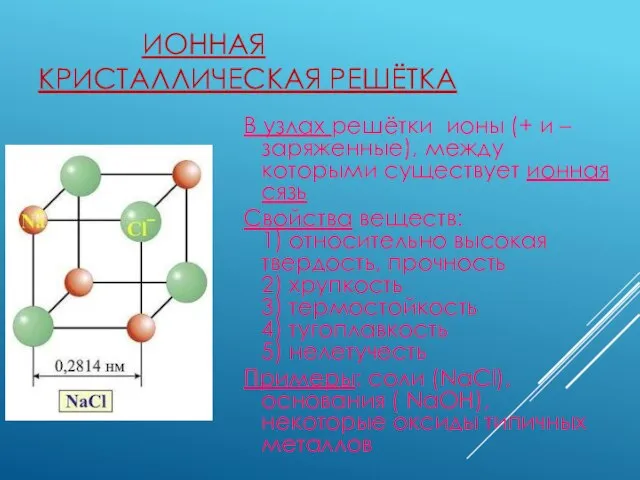
- 4. ИОННАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА В узлах решётки ионы (+ и – заряженные), между которыми существует ионная сязь
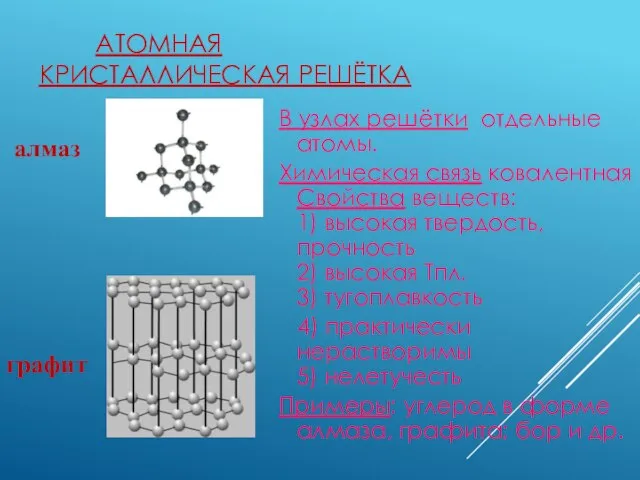
- 5. АТОМНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА В узлах решётки отдельные атомы. Химическая связь ковалентная Свойства веществ: 1) высокая твердость,
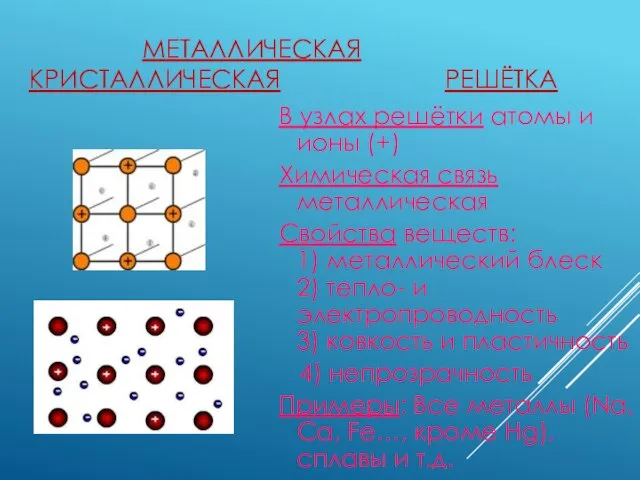
- 6. МЕТАЛЛИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА В узлах решётки атомы и ионы (+) Химическая связь металлическая Свойства веществ: 1)
- 8. МОЛЕКУЛЯРНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА В узлах решетки - молекулы Химическая связь Ковалентная неполярная (между частицами в узлах
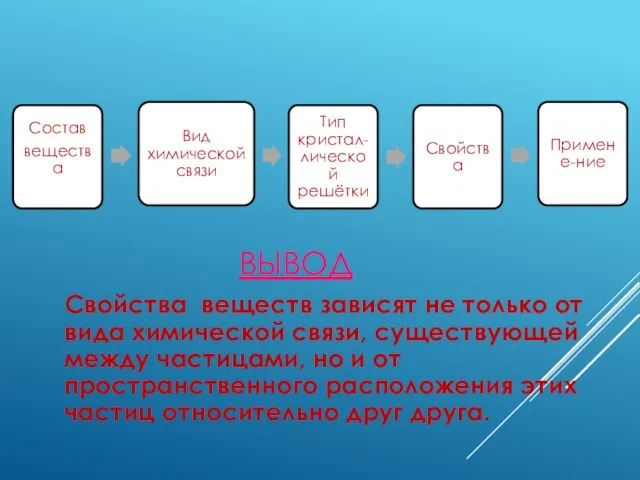
- 9. ВЫВОД Свойства веществ зависят не только от вида химической связи, существующей между частицами, но и от
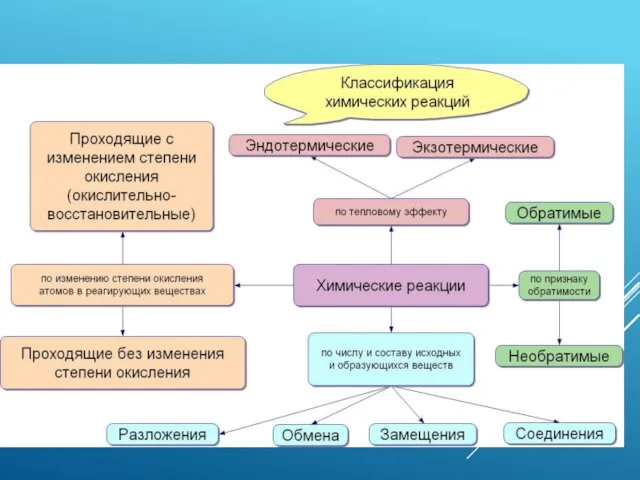
- 12. «эндотермические реакции» - это реакции, протекающие с выделением тепла; «экзотермические реакции» - это реакции, протекающие с
- 13. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ- ЭТО ВЕЛИЧИНА, ПОКАЗЫВАЮЩАЯ ИЗМЕНЕНИЕ МОЛЯРНОЙ КОНЦЕНТРАЦИИ В ЕДИНИЦУ ВРЕМЕНИ. Факторы, влияющие на скорость:
- 14. СКОРОСТЬ РЕАКЦИИ ОПРЕДЕЛЯЕТСЯ ИЗМЕНЕНИЕМ КОЛИЧЕСТВА ВЕЩЕСТВА В ЕДИНИЦУ ВРЕМЕНИ ИЛИ ИЗМЕНЕНИЕМ МОЛЯРНОЙ КОНЦЕНТРАЦИИ ВЕЩЕСТВА ЗА ЕДИНИЦУ
- 16. Скачать презентацию





 Круговорот серы в природе
Круговорот серы в природе Спирты. Классификация
Спирты. Классификация Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Строение атома
Строение атома Презентация на тему Сплавы металлов (9 класс)
Презентация на тему Сплавы металлов (9 класс)  Основания, их классификация и свойства
Основания, их классификация и свойства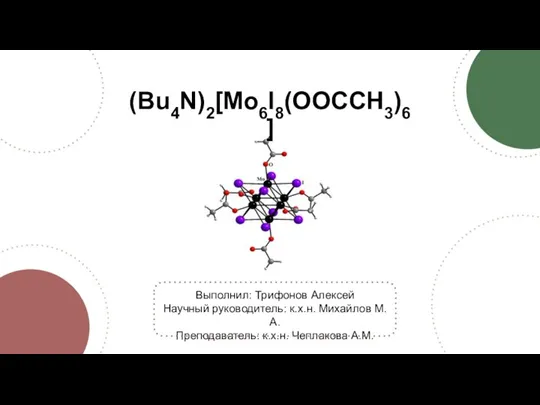 (Bu4N)2[Mo6I8(OOCCH3)6]. Синтез
(Bu4N)2[Mo6I8(OOCCH3)6]. Синтез Общая характеристика галогенов на основе положения химических элементов в периодической системе
Общая характеристика галогенов на основе положения химических элементов в периодической системе Исследование воздействия плазмы метана на свойства оксида графена
Исследование воздействия плазмы метана на свойства оксида графена Типичные ошибки выпускников при решении задач ЕГЭ по органической химии
Типичные ошибки выпускников при решении задач ЕГЭ по органической химии Алкены. Роль алкенов в жизни человека
Алкены. Роль алкенов в жизни человека Срспальфа-олефинсульфанаттар
Срспальфа-олефинсульфанаттар Коштовне каміння
Коштовне каміння Пропиловый спирт C3H7OH
Пропиловый спирт C3H7OH Растворы. Определение
Растворы. Определение Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Металлы. Строение, свойства, применение
Металлы. Строение, свойства, применение Подготовка к контрольной работе
Подготовка к контрольной работе Способы выражения концентраций растворов
Способы выражения концентраций растворов ОВР
ОВР Химические реакции. по фазовому составу
Химические реакции. по фазовому составу Вещество. Простые и сложные вещества
Вещество. Простые и сложные вещества Предельные одноатомные спирты
Предельные одноатомные спирты Азотистые основания. Нуклеотиды и нуклеозиды. ДНК и РНК
Азотистые основания. Нуклеотиды и нуклеозиды. ДНК и РНК Кристаллические решетки, вид связи и свойства веществ
Кристаллические решетки, вид связи и свойства веществ Валентность химических элементов. Определение валентности элементов по формулам их соединений
Валентность химических элементов. Определение валентности элементов по формулам их соединений Пайданалылған майларды қолдана отырып көмірді брикеттер алу
Пайданалылған майларды қолдана отырып көмірді брикеттер алу Водород: знакомый и незнакомый. 9 класс
Водород: знакомый и незнакомый. 9 класс