Слайд 2План:
Понятие о химическом равновесии.
Факторы, влияющие на смещение химического равновесия. Принцип Ле Шателье.
Смещение

химического равновесия (Пример).
Слайд 3Химическое равновесие
Когда скорость прямой реакции, равна скорости обратной реакции наступает химическое равновесие.
υпрям.р-ии=
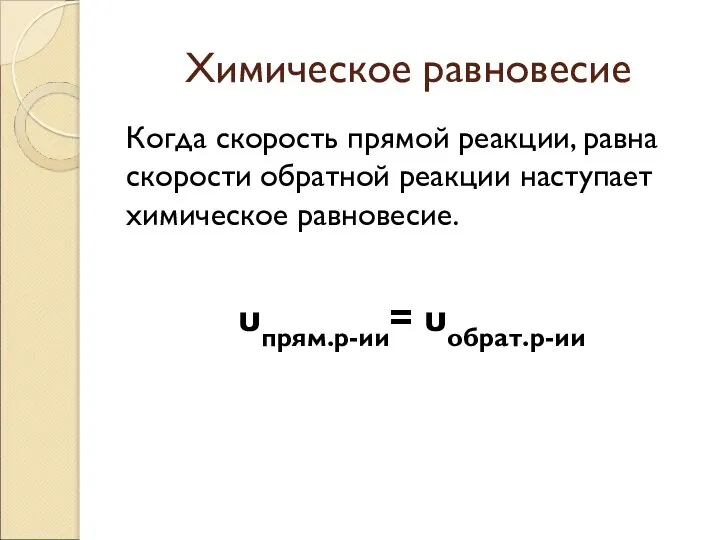
υобрат.р-ии
Слайд 4Анри Луи Ле Шателье (1850–1936)
Принцип
Ле Шателье (принцип смещения химического равновесия или принцип

противоложностей).
Был высказана в общем виде в 1884 году французским ученым Ле Шателье
Слайд 5ПРИНЦИП ЛЕ-ШАТЕЛЬЕ
Если на систему, находящуюся в равновесии оказывается воздействие (изменяется концентрация, давление,

температура), то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
Слайд 6Факторы,
влияющие на смещение химического равновесия
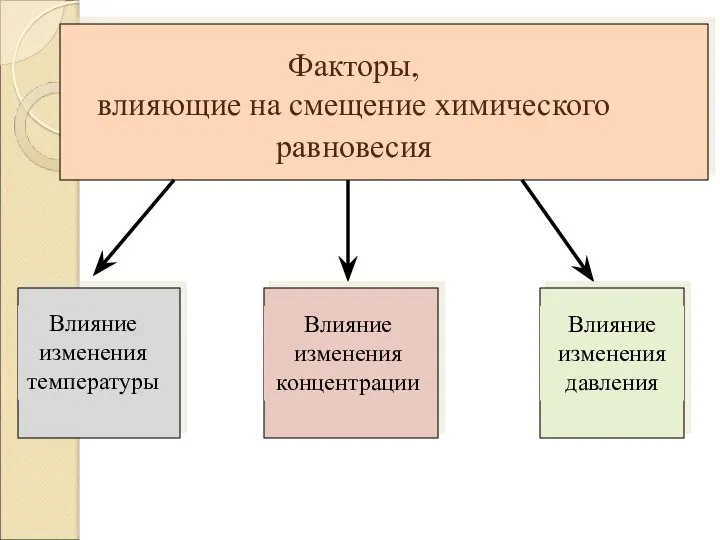
Слайд 7
При повышении концентрации продуктов реакции или исходных веществ ( С ↑
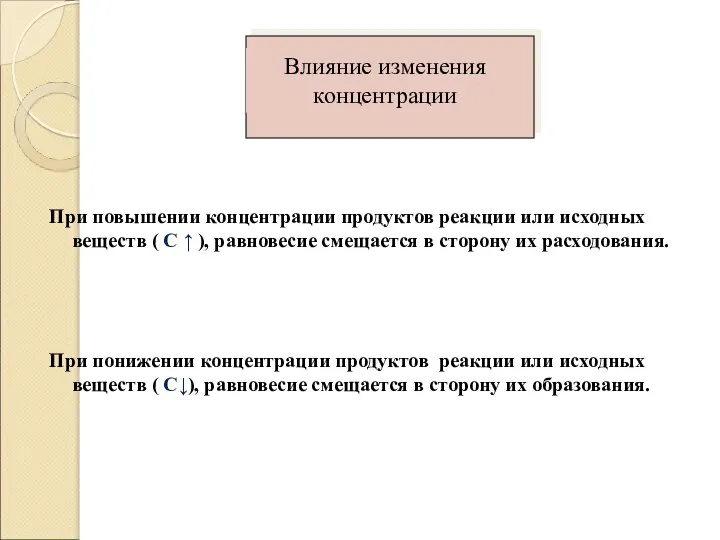
), равновесие смещается в сторону их расходования.
При понижении концентрации продуктов реакции или исходных веществ ( С↓), равновесие смещается в сторону их образования.
Слайд 8Влияние изменения температуры
1. При повышении температуры (Т ↑ ) равновесие смещается в

сторону эндотермической реакции (- Q ).
2NH3 → N2 + 3H2 - Q
2. При понижении температуры (Т ↓ ) равновесие смещается в сторону экзотермической реакции (+ Q).
N2 + 3H2 → 2NH3 + Q
Слайд 9При повышении давления (Р ↑), равновесие смещается в сторону меньшего объема.
N2 (газ)
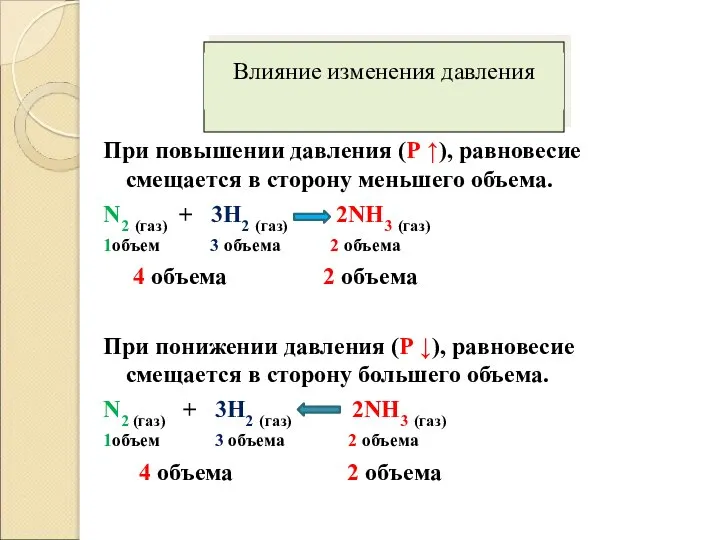
+ 3H2 (газ) 2NH3 (газ)
1объем 3 объема 2 объема
4 объема 2 объема
При понижении давления (Р ↓), равновесие смещается в сторону большего объема.
N2 (газ) + 3H2 (газ) 2NH3 (газ)
1объем 3 объема 2 объема
4 объема 2 объема
Слайд 10
ВЛИЯНИЕ КАТАЛИЗАТОРОВ НА РАВНОВЕСИЕ
КАТАЛИЗАТОРЫ В РАВНОЙ СТЕПЕНИ УСКОРЯЮТ И

ПРЯМУЮ И ОБРАТНУЮ , ИЗМЕНЯЯ ЭНЕРГИЮ АКТИВАЦИИ И ТОЙ И ДРУГОЙ НА ОДНУ И ТУЖЕ ВЕЛИЧИНУ.









 Кислоты в свете теории электролитической диссоциации
Кислоты в свете теории электролитической диссоциации Реакции нуклеофильного присоединения с участием карбонильной группы
Реакции нуклеофильного присоединения с участием карбонильной группы Интенсив. 35 номер
Интенсив. 35 номер Алкены. Роль алкенов в жизни человека
Алкены. Роль алкенов в жизни человека Соли и их свойства
Соли и их свойства Водород в природе. Получение водорода и его физические свойства. 8 класс
Водород в природе. Получение водорода и его физические свойства. 8 класс Физическая химия
Физическая химия Молярная масса вещества
Молярная масса вещества Образование дипептида
Образование дипептида История развития органической химии
История развития органической химии Кислоты в химии
Кислоты в химии Аллотропия кислорода. Состав воздуха
Аллотропия кислорода. Состав воздуха Использование элементов модульной технологии на уроках химии
Использование элементов модульной технологии на уроках химии Характеристика d- элементов: Серебра, Цинка, Ртути
Характеристика d- элементов: Серебра, Цинка, Ртути Скорость химических реакций
Скорость химических реакций Медь
Медь Презентация на тему Целлюлоза
Презентация на тему Целлюлоза  Этанол. Химические свойства этанола
Этанол. Химические свойства этанола Химический элемент натрий
Химический элемент натрий Электролитическая диссоциация
Электролитическая диссоциация Галоген тобы бар полимерлер
Галоген тобы бар полимерлер Гармонизации терминологии аналитической химии с использованием электронной системы на основе MS WSS (Windows SharePoint Services) Широкова В.И.,
Гармонизации терминологии аналитической химии с использованием электронной системы на основе MS WSS (Windows SharePoint Services) Широкова В.И.,  Horenie
Horenie Презентация на тему Химические антонимы
Презентация на тему Химические антонимы  Ионная химическая связь
Ионная химическая связь Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях
Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях Опыты с водой
Опыты с водой Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации