Содержание
- 2. « химия» mdl.agni-rt.ru Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени
- 3. «Общая химия» mdl.agni-rt.ru Факторы, влияющие на скорость химической реакции На то, насколько быстро будет происходить химическое
- 4. « химия» mdl.agni-rt.ru Концентрация реагентов В процессе химического взаимодействия частицы реагирующих веществ сталкиваются друг с другом.
- 5. «химия» mdl.agni-rt.ru Природа реагентов Так как в процессе взаимодействия разрушаются химические связи реагирующих веществ и образуются
- 6. « химия» mdl.agni-rt.ru Температура реакции При увеличении температуры энергия сталкивающихся частиц возрастёт, очевидно, что с ростом
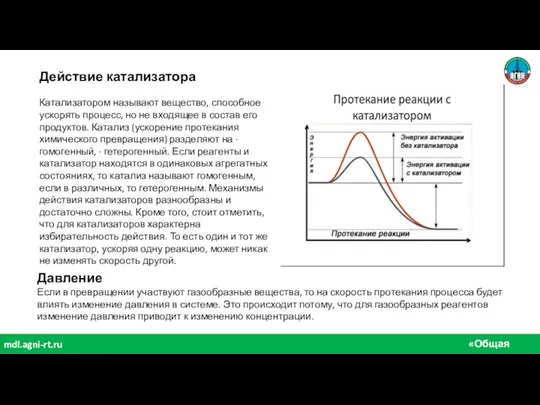
- 7. «Общая химия» mdl.agni-rt.ru Действие катализатора Катализатором называют вещество, способное ускорять процесс, но не входящее в состав
- 8. «Общая химия» mdl.agni-rt.ru Обратимые и необратимые процессы Обратимые химические реакции- реакции, одновременно протекающие в прямом и
- 9. «Общая химия» mdl.agni-rt.ru Химическое равновесие в гомогенных системах При равенстве энтальпийного и энтропийного факторов ΔН =
- 10. «Общая химия» mdl.agni-rt.ru Эти уравнения являются математическими выражениями закона действующих масс, открытого норвежскими учеными К. Гульдбергом
- 11. « химия» mdl.agni-rt.ru 2. Влияние температуры на константу равновесия Из вышеприведенного уравнения следует lnКс = -
- 12. «Общая химия» mdl.agni-rt.ru 3. Принцип Ле Шателье При изменении равновесных концентраций исходных веществ и продуктов реакции
- 13. «Общая химия» mdl.agni-rt.ru Способы смещения химического равновесия Влияние давления Влияние давления определяется знаком изменения объема ∆V
- 14. « химия» mdl.agni-rt.ru Ионное произведение воды Вода является слабым амфолитом ( может быть донором и акцептором
- 15. «Общая химия» mdl.agni-rt.ru Среда водных растворов –определяется соотношением концентраций двух ионов H+ и OH-, которые всегда
- 16. « химия» mdl.agni-rt.ru Водородным показателем рН называют десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
- 17. «Общая химия» mdl.agni-rt.ru Аналогично концентрацию ОН--ионов можно выразить через показатель гидроксид-ионов рОН: гидроксильным показателем рОНназывают десятичный
- 18. «Общая химия» mdl.agni-rt.ru Произведение растворимости – величина, количественно характеризующая способность электролита растворяться в насыщенном растворе при
- 19. «Общая химия» mdl.agni-rt.ru Произведения растворимости некоторых соединений.
- 21. Скачать презентацию

















 Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека  Ортофосфорная кислота
Ортофосфорная кислота Предмет химии. Один из способов познания окружающего мира, основанный на объективных данных
Предмет химии. Один из способов познания окружающего мира, основанный на объективных данных Химические явления. Закон сохранения массы веществ
Химические явления. Закон сохранения массы веществ Презентация на тему Сахароза
Презентация на тему Сахароза  Теория химического строения А. М. Бутлерова
Теория химического строения А. М. Бутлерова Получение метанола из синтез-газа
Получение метанола из синтез-газа Карбоновые кислоты
Карбоновые кислоты 60d677dc87dcd9320c87dd4e7b80d6ac
60d677dc87dcd9320c87dd4e7b80d6ac Коррозионные диаграммы
Коррозионные диаграммы 4.1-2 Генетическая связь+
4.1-2 Генетическая связь+ Презентация на тему Угарный газ
Презентация на тему Угарный газ 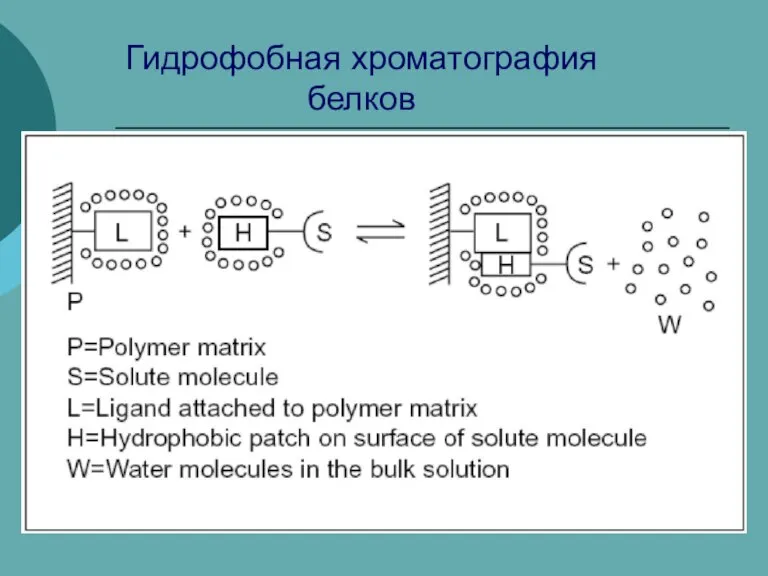 Гидрофобная хроматография белков
Гидрофобная хроматография белков Классификация реагентов и реакции в органической химии
Классификация реагентов и реакции в органической химии История развития технологий термического крекинга в России и мире
История развития технологий термического крекинга в России и мире Серная кислота
Серная кислота Типы химической реакции
Типы химической реакции Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Железо и его соединения
Железо и его соединения Каучук
Каучук Презентация на тему Почему протекают химические реакции
Презентация на тему Почему протекают химические реакции  Презентация на тему Применение интерактивной доски на уроках химии
Презентация на тему Применение интерактивной доски на уроках химии  Основные химические понятия и законы химии. (Часть 2)
Основные химические понятия и законы химии. (Часть 2) X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии
X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии Химия в системе современных естественнонаучных представлений
Химия в системе современных естественнонаучных представлений Физические и химические свойства азота
Физические и химические свойства азота Строение и химические свойства глюкозы
Строение и химические свойства глюкозы Реактор гидроочистки дизельного топлива
Реактор гидроочистки дизельного топлива