Слайд 2Строение атомов и степени окисления
Галогены – элементы главной подгруппы VII группы.
На

внешнем энергетическом уровне они содержат по 7 электронов.
У атомов всех галогенов, кроме фтора, в возбужденном состоянии увеличивается количество неспаренных электронов, поэтому они могут проявлять степени окисления
+1, +3, +5 и +7.
F: 2s2 2p5 Cl, Br, I: ns2np5 nd0
+7 Hal2O7, HHalO4, HalO4-
+5 Hal2O5, HHalO3, HalO3-
+3 Hal2O3, HHalO2, HalO2-
+1 Hal2O, HHalO, HalO-
0 F2 0 Hal2
-1 HF, F- -1 HHal, Hal-
Слайд 4Химические свойства простых веществ

Слайд 5Химические свойства простых веществ
3. С водой
При растворении хлора в воде образуется

хлорная вода (хлорка), представляющая собой смесь соляной и хлорноватистой кислот:
Cl2 + H2O0 = HCl+1O + HCl-1
HClO = HCl + [O] (или суммарно 2Cl2 +2H2O = O2 + 4HCl).
Бром при контакте с водой ведет себя подобно хлору.
Иод практически не растворим в воде, но его растворимость резко повышается в присутствии иодида калия:
I2 + KI = K[I3].
Во фторе вода горит:
2F2 + 2H2O = 4HF + O2.
4. Со щелочами
При пропускании хлора через растворы щелочей на холоду
(при ~0 °С) образуются хлорид и гипохлорит:
2KOH + Cl20 = KCl-1 + KCl+1O + H2O
2Ca(OH)2 + 2Cl20 = CaCl2-1 + Ca(Cl+1O)2 + 2H2O
CaCl2 + Ca(ClO)2 = CaOCl2 – «белильная известь»
При нагревании реакция идет с образованием хлорида и хлората:
6KOH + 3Cl20 → 5KCl-1 + KCl+5O3 + 3H2O
Бром и иод реагируют со щелочами аналогичным образом.
Слайд 6Химические свойства простых веществ
5. С галогенидами
Более активные галогены вытесняют из солей менее

активные.
2NaBr + Cl2 = 2NaCl + Br2
NaBr + I2 ≠
6. С другими сложными веществами
Фтор, хлор и бром при взаимодействии с различными сложными веществами обычно проявляют окислительные свойства,
например:
SiO2 + 2F2 = SiF4 + O2
3Cl2 + 2Cr(OH)3 + 10KOH = 6KCl + 2K2CrO4 + 8H2O
2FeBr2 + Br2 = 2FeBr3.
Для иода характерны и окислительные,
и восстановительные свойства:
H2S + I20 = S + 2HI-1
I20 + 10HNO3 = 2HI+5O3 + 10NO2 + 4H2O.
Слайд 7Галогеноводороды и галогениды
HF – жидкость (tкип = 190С), ядовитая, слабая кислота,
между

молекулами есть водородные связи
HCl, HBr, HI – газы с резким запахом, ядовитые,
очень хорошо растворяются в воде с образованием сильных кислот.
Химические свойства галогеноводородов
1. Общие кислотные свойства
Fe + 2HCl = FeСl2+ H2
CaCO3 + 2HI = CaI2 + H2O + CO2
KOH + HF = KF + H2O
Cu(OH)2 + 2HBr = CuBr2 + 2H2O
Иодиды меди (II) и железа (III) разлагаются:
2CuO + 4HI = 2CuI + I2 + 2H2O
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
2. Восстановительные свойства
6HBr + KClO3 = 3Br2 + KCl + 3H2O
4HI + SO2 = 4I2 + S + 2H2O
3. Травление стекла плавиковой кислотой
SiO2 + 4HF = SIF4 + 2H2O
Слайд 8Кислородсодержащие
соединения хлора
Сила кислородсодержащих кислот растет в ряду: HClO → HClO2 →

HClO3 → HClO4.
HClO, HClO2 , HClO3 – не стабильны, при попытке выделения взрываются.
HClO4 - устойчива, получена в чистом виде.
Соответствующие оксиды хлора также нестабильны и взрываются при комнатной температуре.







 Оборудование и реактивы
Оборудование и реактивы Химия. Введение в предмет (8 класс)
Химия. Введение в предмет (8 класс)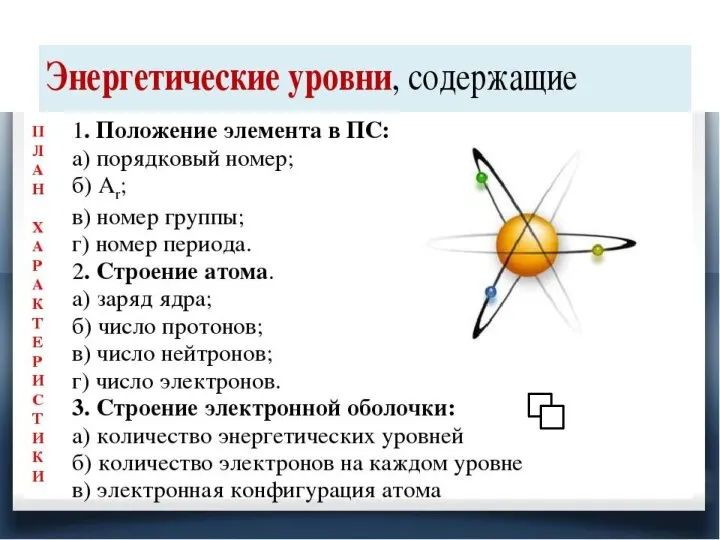 Закономерности изменения свойств атомов химических элементов
Закономерности изменения свойств атомов химических элементов Бутлєров
Бутлєров Методы разделения и очистки веществ
Методы разделения и очистки веществ Алкины. Ацетилен
Алкины. Ацетилен Кислород Общая характеристика, получение и свойства
Кислород Общая характеристика, получение и свойства Получение меди
Получение меди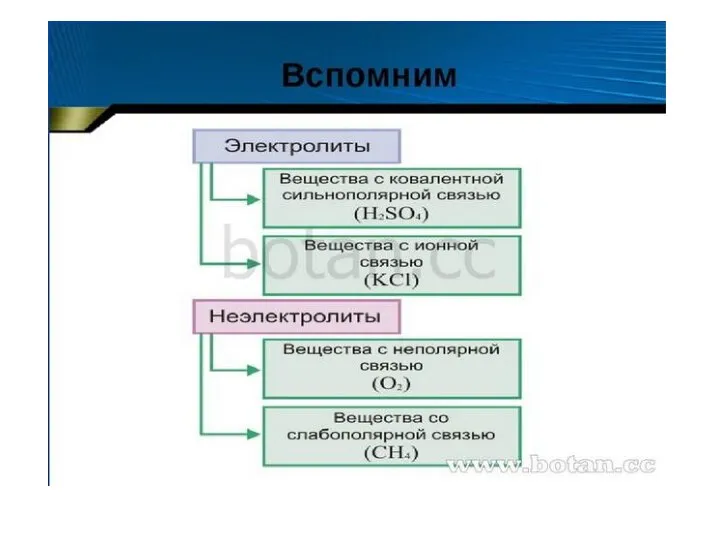 Диссоциация кислот, щелочей солей
Диссоциация кислот, щелочей солей Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия
Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия d-элементы.Распространение в природе и основные материалы
d-элементы.Распространение в природе и основные материалы Примеры карбоновых кислот
Примеры карбоновых кислот Химическая связь и строение вещества
Химическая связь и строение вещества Получение галогеноалканов
Получение галогеноалканов Презентация на тему Алюминий(Al)
Презентация на тему Алюминий(Al)  Полезные ископаемые
Полезные ископаемые Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы
Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы Валентность и ковалентность химической связи
Валентность и ковалентность химической связи Виды химической связи
Виды химической связи Структура материалов. Введение в науку о материалах
Структура материалов. Введение в науку о материалах Алкены
Алкены Галогены. Положение галогенов в ПСХЭ
Галогены. Положение галогенов в ПСХЭ Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II
Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II Типы химических реакций. 8 класс
Типы химических реакций. 8 класс