Содержание
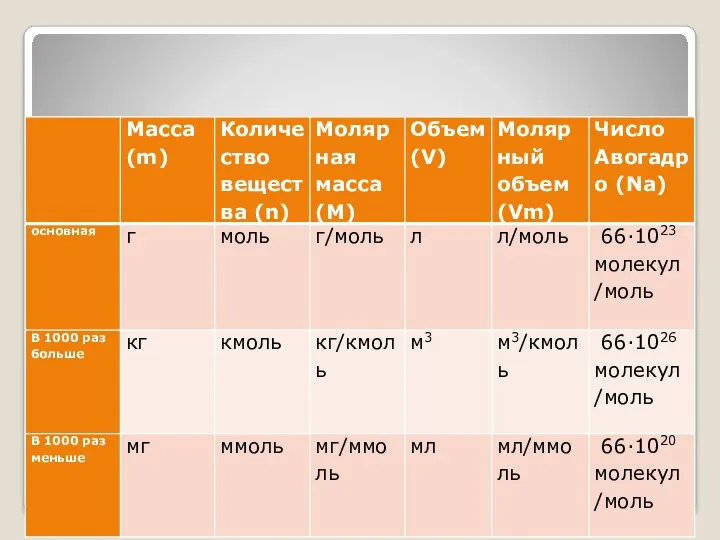
- 2. Моль – такое количество вещества, в котором содержится 6∙1023 молекул этого вещества. Молярная масса – масса
- 3. Буквенные обозначения: Количество вещества - n Молярный объем - Vm Молярная масса - M Масса -
- 4. Основные формулы
- 5. Массовая доля. Массовая доля элементов в веществе. Буквенные обозначения ω – массовая доля (в долях от
- 6. Массовая и объемная доли компонентов смеси (раствора). Буквенные обозначения ω – массовая доля (в долях от
- 7. Расчет массовой или объемной доли выхода продукта реакции от теоретически возможного. Выход продукта реакции от теоретически
- 8. Расчет теплового эффекта реакции. Экзотермические реакции – протекают с выделением теплоты +Q Эндотермические реакции – протекают
- 9. Алгоритм решения задачи . Внимательно прочтите условия задачи 2-3 раза. 2. Кратко запишите, что дано (известно)
- 10. Задачи 1.Определите объем (н.у.) сероводорода массой 13,6 г. 2.Определите массу кислорода объемом 33,6 л(н.у.) 3.Газовая смесь
- 11. 5. Оксид элемента имеет состав ЭО3 Массовая доля кислорода в этом оксиде составляет 60%. Определите какой
- 12. Хлорид элемента имеет состав ЭСl2 Массовая доля хлора в этом хлориде составляет 52,21%. Определите какой элемент
- 13. Определите молярную массу оксида углерода, плотность которого по воздуху составляет 1,51. Какой это оксид углерода?
- 14. Решить самостоятельно
- 15. Массовые доли углерода, азота и водорода равны соответственно 53,33, 31,11 и 15,5%. Вывести молекулярную формулу. Массовые
- 16. Задачи на растворы
- 17. В 300 г воды растворили 20 г глюкозы. Определите массовую долю глюкозы в полученном растворе. Вычислите
- 18. Из 10 кг раствора с массовой долей хлорида натрия 20% при охлаждении выделилось 400г. соли. Чему
- 19. Какую массу раствора с массовой долей гидроксида калия 20% надо прибавить к 1 кг раствора с
- 20. Вычислить среднюю скорость реакции CO + NO2 = CO2 + NO если начальная концентрация CO была
- 21. Задачи по теме скорость химических реакций
- 22. Как изменится скорость химической реакции при повышении температуры реакционной смеси от 20 градусов до 50, если
- 23. Во сколько раз изменится скорость реакции, уравнение которой 2NO + O2 = 2NO2 При увеличении концентрации
- 24. При температуре 20 градусов некоторая реакция заканчивается через 40 минут. Вычислить, через сколько минут закончится эта
- 25. Вычислите как изменится скорость реакции: а) при повышении температуры на 30 градусов. б) при понижении температуры
- 27. Скачать презентацию























 Закономерности управления каталитическими процессами. Катализ
Закономерности управления каталитическими процессами. Катализ кулонометрия Дастан
кулонометрия Дастан Коррозия металлов и ГЭ
Коррозия металлов и ГЭ Алканы. Этан
Алканы. Этан Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Классификация методов аналитической химии
Классификация методов аналитической химии Ароматические углеводороды
Ароматические углеводороды Каучук. История открытия каучука
Каучук. История открытия каучука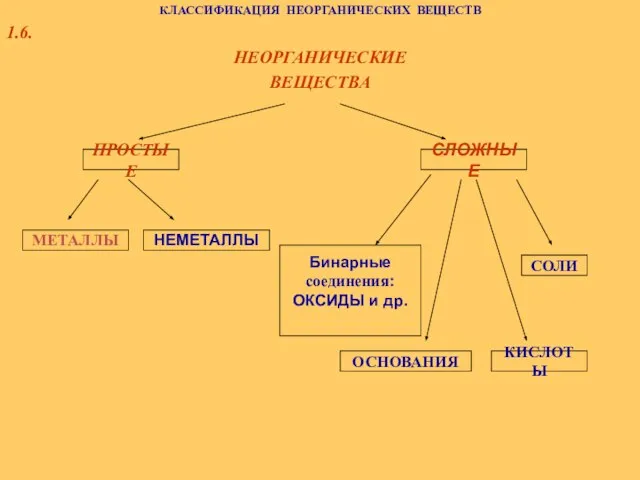 Классификация неорганических веществ
Классификация неорганических веществ Химический состав молока
Химический состав молока Стереоизомерия
Стереоизомерия Карбоновые кислоты
Карбоновые кислоты Пептиды, белки. Лабораторное занятие
Пептиды, белки. Лабораторное занятие Жаропрочные и жаростойкие стали
Жаропрочные и жаростойкие стали Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары
Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары Nevarne snovi
Nevarne snovi Кальций и его соединения
Кальций и его соединения Растворы. Часть 2
Растворы. Часть 2 Хроматография. Особенности метода хроматографии
Хроматография. Особенности метода хроматографии Презентация на тему Путешествие по континенту Химия, познавательная игра по химии, 8 класс
Презентация на тему Путешествие по континенту Химия, познавательная игра по химии, 8 класс  Нуклеинови киселини
Нуклеинови киселини Протолитическая теория кислот и оснований. Буферные растворы
Протолитическая теория кислот и оснований. Буферные растворы Амины, азо- и диазосоединения (продолжение)
Амины, азо- и диазосоединения (продолжение) Ионные равновесия в растворах
Ионные равновесия в растворах Химические вещества
Химические вещества Химическая связь
Химическая связь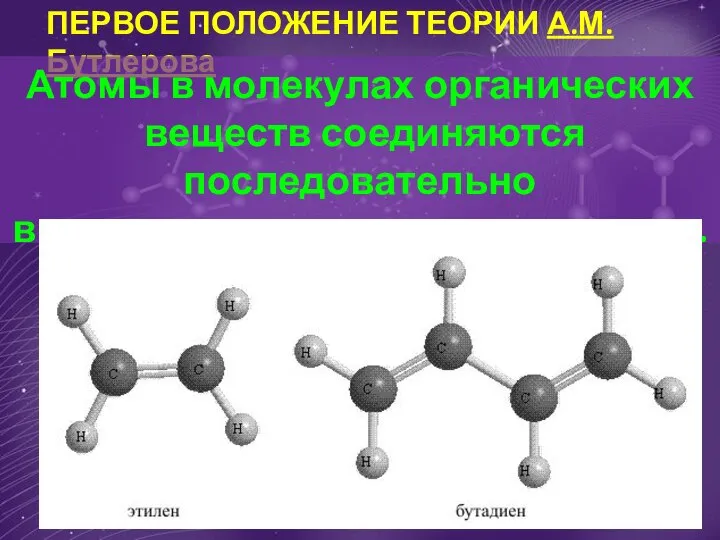 Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно
Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно