Содержание
- 2. ЛЕКЦИЯ №3 Основные классы неорганических соединений ОП. 05 Химия 1 курс 1 семестр Составитель: преподаватель Кобзева
- 3. Все неорганические вещества можно разделить на классы. Каждый класс объединяет вещества, сходные по составу и по
- 4. ПРОСТЫЕ ВЕЩЕСТВА делятся на: металлы (Na, Fe, Cu), неметаллы (S, Cl2, P) инертные газы (Ne, Rn,
- 5. Поскольку все МЕТАЛЛЫ образуют кристаллическую структуру одного и того же типа, физические свойства их во многом
- 6. Свойства простых веществ неметаллов при обычных условиях отличаются большим многообразием. В первую очередь, это касается агрегатного
- 7. Газообразные при обычных условиях неметаллы существуют в виде двухатомных (Н2, О2, CI2, N2) или одноатомных (благородные
- 8. Молекулярное состояние имеют также бром (Br2), белый фосфор (P4), и сера (S8), но из-за значительно большей
- 9. К сложным неорганическим соединениям относятся: оксиды, основания, кислоты, амфотерные гидроксиды, соли. Молекулы сложных веществ состоят из
- 10. Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Все оксиды делятся
- 11. Амфотерным оксидам отвечают гидраты, проявляющие и кислотные, и основные свойства. Амфотерные обычно для металлов со степенью
- 12. Гидроксиды принято рассматривать как продукты гидратации оксидов, то есть как продукты присоединения воды. Некоторые гидроксиды можно
- 13. Щёлочи. Нерастворимые основания 1. Действие на индикаторы. лакмус - синий метилоранж - жёлтый фенолфталеин – малиновый
- 14. Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. Классификация 1. По составу: бескислородные
- 15. Бескислородные: Название соли HCl - хлористоводородная (соляная) одноосновная хлорид HBr – бромистоводородная одноосновная бромид HI -
- 16. Кислородсодержащие: HNO3 - азотная одноосновная нитрат H2SO3 - сернистая двухосновная сульфит H2SO4 - серная двухосновная сульфат
- 17. Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс
- 18. Кислые. При диссоциации дают катионы металла (NH4+), ионы водорода и анионы кислотного остатка. NaHCO3 « Na+
- 19. Смешанные. Образованы одним катионом и двумя анионами: CaOCl2 « Ca2+ Cl- + OCl- Комплексные. Содержат сложные
- 20. Химические свойства неорганических веществ рассматриваются с точки зрения теории электролитической диссоциации. Среди неорганических соединений электролитами в
- 21. Кислоты — это электролиты, образующие при электролитической диссоциации в качестве катионов только катионы водорода. Число ионов
- 22. В зависимости от величины степени диссоциации кислоты делятся на сильные и слабые. Сильные кислоты являются сильными
- 23. В ионных уравнениях формулы записываются в диссоциированном виде. Слабые кислоты являются слабыми электролитами, диссоциированы в незначительной
- 25. Скачать презентацию






















 Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны
Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны Свойства глюкозы
Свойства глюкозы Металдар мен қорытпалардың құрылысы және қасиеттері
Металдар мен қорытпалардың құрылысы және қасиеттері Презентация на тему Интерактивная игра "Химический лабиринт"
Презентация на тему Интерактивная игра "Химический лабиринт"  Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева строение атома
строение атома Техносферная безопасность. Химия как наука
Техносферная безопасность. Химия как наука Золото
Золото Серная кислота
Серная кислота Презентация на тему Бинарные соединения
Презентация на тему Бинарные соединения  Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  Количество вещества. Моль
Количество вещества. Моль Вода - растворитель
Вода - растворитель Арены – ароматические углеводороды
Арены – ароматические углеводороды Обобщение и систематизация знаний по теме Вещества и их классификация
Обобщение и систематизация знаний по теме Вещества и их классификация Презентация на тему Строение атома и атомного ядра
Презентация на тему Строение атома и атомного ядра  Химическое равновесие
Химическое равновесие Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы
Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы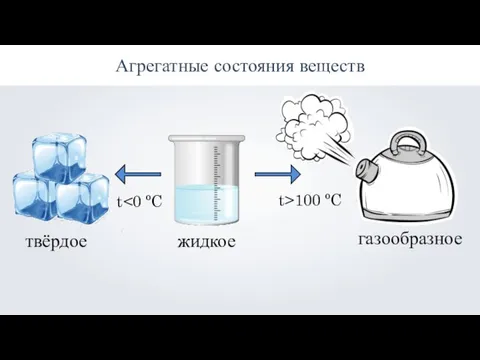 Агрегатные состояния веществ: твёрдое, жидкое, газообразное
Агрегатные состояния веществ: твёрдое, жидкое, газообразное Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Изучение процесса замерзания воды
Изучение процесса замерзания воды Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Сахароза (С12Н22О11)
Сахароза (С12Н22О11) Алкены. Этилен C2H4
Алкены. Этилен C2H4 Умники и умницы в Королевстве Химических наук
Умники и умницы в Королевстве Химических наук Ксантановая камедь
Ксантановая камедь