Содержание
- 2. План урока 1. Галогеноводородные кислоты. 2. Соляная кислота и её свойства. 3. Соли галогеноводородных кислот. Галогениды.
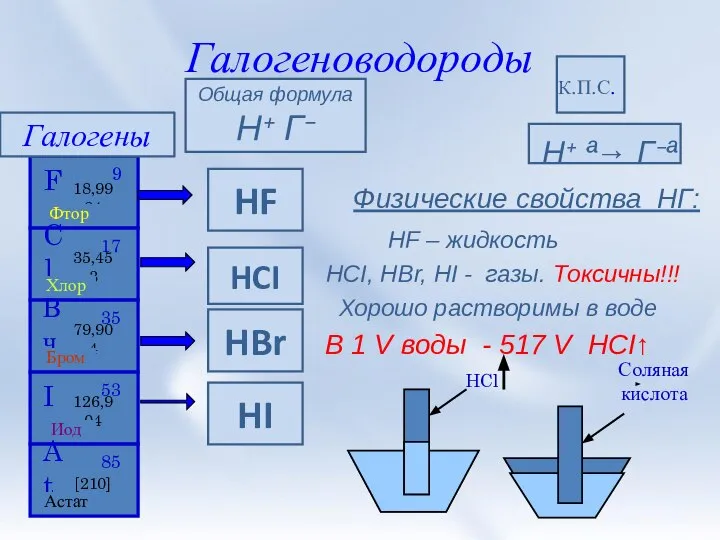
- 3. Галогеноводороды Н⁺ ª→ Г⁻ª Физические свойства НГ: HF – жидкость HCI, HBr, HI - газы. Токсичны!!!
- 4. Определите степени окисления хлора в его соединениях HClO HClO2 HClO3 HClO4 хлорноватистая хлористая хлорноватая хлорная кислота
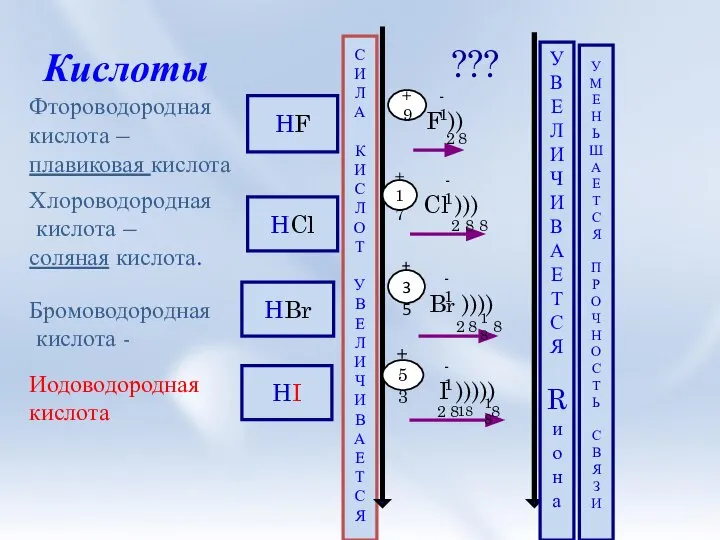
- 5. Кислоты Фтороводородная кислота – плавиковая кислота Хлороводородная кислота – соляная кислота. Бромоводородная кислота - HF Иодоводородная
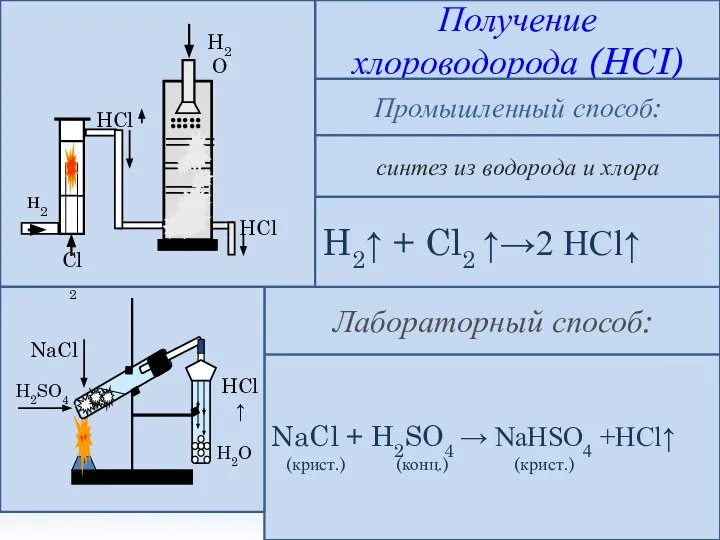
- 6. Получение хлороводорода (HCI) синтез из водорода и хлора Промышленный способ: NaCl + H2SO4 → NaHSO4 +HCl↑
- 7. Соляная кислота - HCL Бесцветная жидкость, с резким запахом, дымит на воздухе М = ? HCl
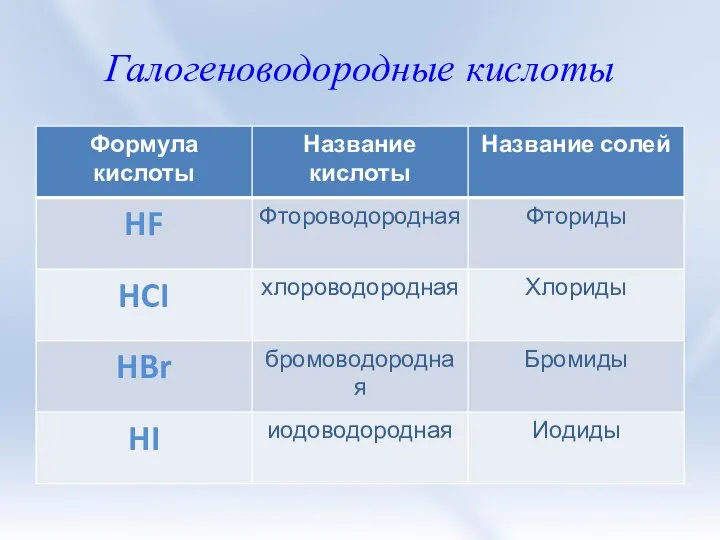
- 8. Галогеноводородные кислоты
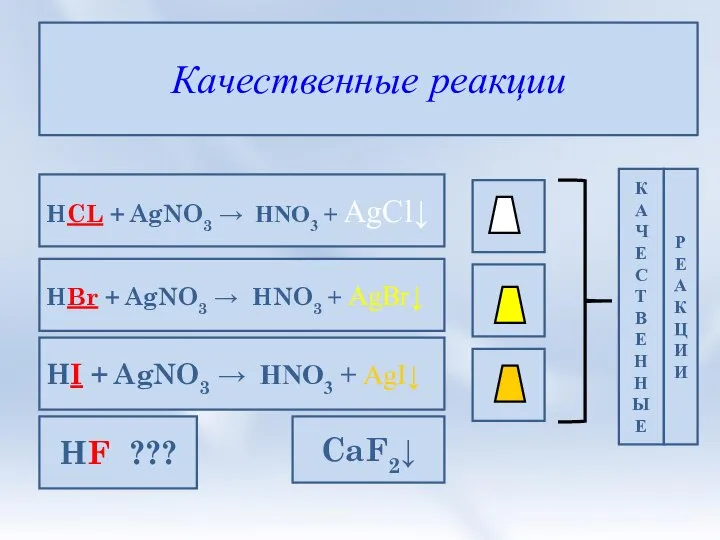
- 9. Качественные реакции HCL + AgNO3 → HNO3 + AgCl↓ HBr + AgNO3 → HNO3 + AgBr↓
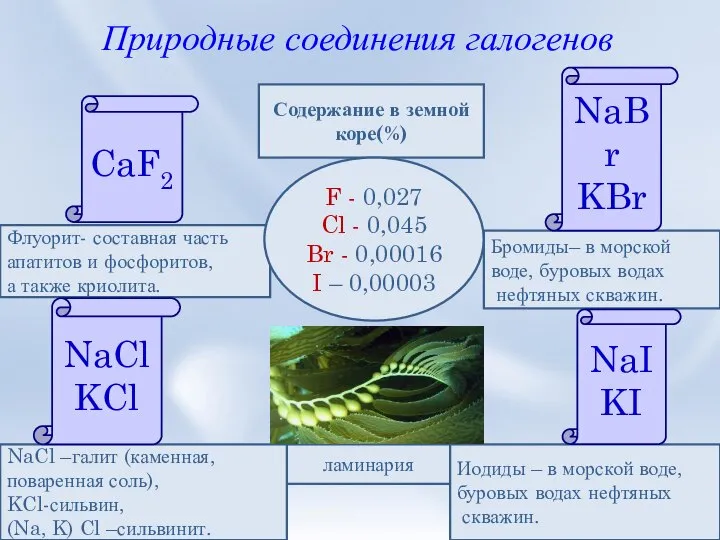
- 10. Природные соединения галогенов Флуорит- составная часть апатитов и фосфоритов, а также криолита. Содержание в земной коре(%)
- 12. Скачать презентацию



 Металлы общая характеристика
Металлы общая характеристика Методы исследования структуры кристаллов
Методы исследования структуры кристаллов относительная атомная масса
относительная атомная масса Коррозия металлов
Коррозия металлов Общая характеристика галогенов
Общая характеристика галогенов Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения Удивительные свойства латекса и его применение
Удивительные свойства латекса и его применение Лекция 1 Основные понятия и законы химии
Лекция 1 Основные понятия и законы химии Алюминий
Алюминий Алифатические углеводороды
Алифатические углеводороды Синтетические органические соединения
Синтетические органические соединения Медь и её сплавы
Медь и её сплавы Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов
Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов Полипропилен (ПП)
Полипропилен (ПП) Алкадиены. Каучук. История открытия каучука
Алкадиены. Каучук. История открытия каучука Выделение веществ из смеси
Выделение веществ из смеси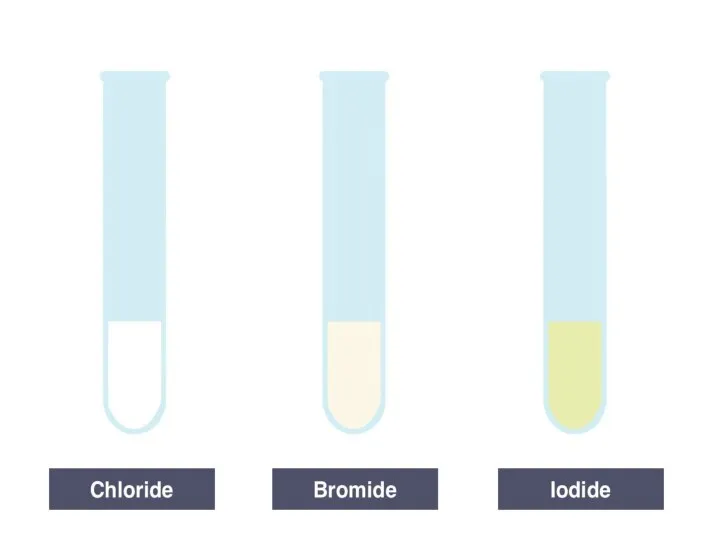 Определение галогенид-ионов в водном растворе. Лабораторный опыт
Определение галогенид-ионов в водном растворе. Лабораторный опыт Презентация на тему Викторина "Узнай химический элемент"
Презентация на тему Викторина "Узнай химический элемент"  Сплавы металлов (познавательная презентация)
Сплавы металлов (познавательная презентация) Презентация на тему Количество вещества
Презентация на тему Количество вещества  Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа
Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа ізомери
ізомери Свойства глюкозы
Свойства глюкозы МОУ СОШ №3 г. Хвалынска Саратовской области Тема: Ковалентная полярная связь Учитель химии и биологии Высшей квалификационно
МОУ СОШ №3 г. Хвалынска Саратовской области Тема: Ковалентная полярная связь Учитель химии и биологии Высшей квалификационно Комплексонометрическое титрование. 5 лекция. Часть 2
Комплексонометрическое титрование. 5 лекция. Часть 2 Получение и применение порфиринов и их аналогов
Получение и применение порфиринов и их аналогов Презентация на тему Сплавы металлов (9 класс)
Презентация на тему Сплавы металлов (9 класс)  Разбор задач
Разбор задач