Содержание
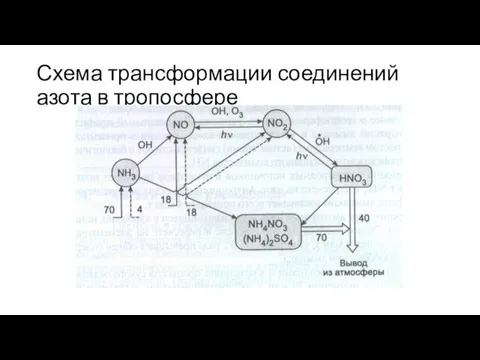
- 2. Схема трансформации соединений азота в тропосфере
- 3. Среднее содержание газообразного аммиака в приземном слое воздуха составляет 0,3-9,1 мгк*м-3 и резко падает с подъемом
- 4. В тропосфере аммиачный азот представлен, в основном, содержащимися в аэрозолях ионами аммония. Общее содержание NH4+ ионов,
- 5. Часть аммиака (от 3 до 8 млн. т*год-1) вступает во взаимодействие со свободными радикалами, в основном
- 6. Под общей формулой оксидов азота NOx обычно подразумевают NO, NO2 и N2O. Среднее значение концентрации гемиоксида
- 7. Окисление азота воздуха в процессах горения Пример Константа равновесия реакции образования оксида азота из азота и
- 8. Решение. Процесс образования молекул оксида азота из азота и кислорода воздуха может быть представлен следующим уравнением:
- 9. Представим равновесные значения компонентов смеси в виде таблицы
- 10. Парциальные давления азота и кислорода соответствуют значениям, характерным для сухого воздуха при нормальном атмосферном давлении: Рi
- 11. 3 * 10-11 = 4х2 / 79.12 * 22,23 х = Р(NO) = 22,97 * 10
- 12. Оксид и диоксид азота в тропосфере подвергаются взаимным превращениям Как известно, NO в присутствии кислорода может
- 13. В тропосфере NO, взаимодействуя с гидропероксидным радикалом, переходит в диоксид азота: NO+HO2 = NO2 + OH
- 14. ПРИМЕР Известно, что окисление оксида азота (NO) может протекать при взаимодействии с молекулярным кислородом и озоном.
- 15. Решение. Определим время полувыведения оксида азота из воздуха при его взаимодействии с молекулярным кислородом. Процесс окисления
- 16. Концентрация молекул кислорода в приземном слое воздуха равна 20,95 об. %, что составляет: [O2] = 2,55
- 17. Для реакций второго порядка время, или период, полувыведения, то есть время, за которое концентрация исходных реагентов
- 18. Определим время полувыведения оксида азота из приземного слоя воздуха при его взаимодействии с озоном. В этом
- 19. Поскольку концентрация озона более чем в сто раз больше концентрации оксида азота, можно принять, что в
- 20. В рассматриваемом нами случае для реакции псевдо-первого порядка имеем: t1/2 = 0,693 / К = 0,693
- 21. Диоксид азота в тропосфере в присутствии излучения длиной волны λ NO2 + hν = NO +
- 22. Важной частью атмосферного цикла соединений азота является образование азотной кислоты. Примерно 44% азотной кислоты в тропосфере
- 23. Основное количество азотной кислоты выводится из тропосферы с атмосферными осадками в виде растворов HNO3 и её
- 24. Оценка масштабов антропогенных поступлений соединений серы и азота в атмосферу Пример Оцените мольное отношение и общую
- 25. Решение Появление диоксида серы в выбросах отходящих газов при сжигании топлива связано с процессом окисления соединений
- 26. Количество молей диоксида серы, образующегося в процессе горения угля, равное количеству молей серы, содержащейся в угле,
- 27. Для вычисления количества молей оксида азота, образующегося в процессе горения угля, необходимо найти общее количество молей
- 28. Процесс окисления углерода можно представить уравнением: С + О2 = СО2 Каждые сутки на станции сжигается
- 29. На каждый моль углерода образуется моль диоксида углерода и расходуется, как и при окислении серы, один
- 30. Поскольку в процессе сжигания угля используется воздух, кислород из которого, по условию задачи, будет полностью израсходован
- 31. Общее количество молей газов, содержащихся в отходящих продуктах сжигания угля, составит: N (общее) = 3,08 *
- 32. Массы диоксида серы и оксида азота, поступающего в атмосферу в процессе сжигания угля, можно определить по
- 34. Скачать презентацию






























 Творческий отчет кружка Юные химики
Творческий отчет кружка Юные химики Белки
Белки С - углерод. Применение
С - углерод. Применение Презентация на тему Алмаз, графит и фуллерен
Презентация на тему Алмаз, графит и фуллерен  Цветные металлы и сплавы
Цветные металлы и сплавы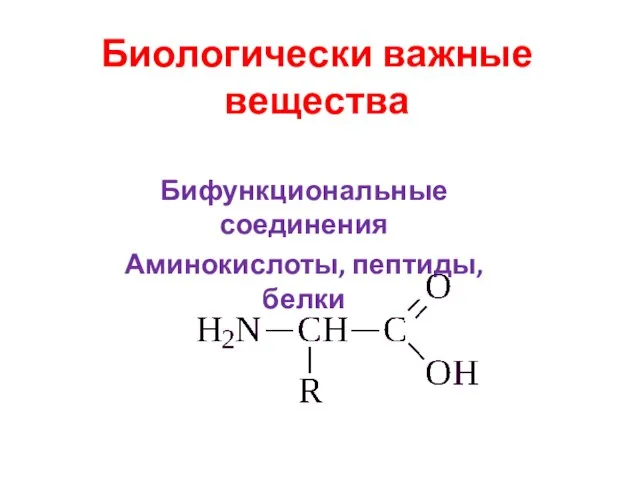 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Решение расчетных задач на нахождение химической формулы вещества
Решение расчетных задач на нахождение химической формулы вещества Ацилирование. Лекция 4
Ацилирование. Лекция 4 Алмашу реакциясе
Алмашу реакциясе Пористые стекла
Пористые стекла Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия Презентация на тему Производство аммиака
Презентация на тему Производство аммиака  Учебное задание Расчет теплоты сгорания
Учебное задание Расчет теплоты сгорания Тела и вещества. Химический диктант
Тела и вещества. Химический диктант Реакции нуклеофильного присоединения с участием карбонильной группы
Реакции нуклеофильного присоединения с участием карбонильной группы Дисперсные системы
Дисперсные системы Полезные ископаемые
Полезные ископаемые Процестер және аппараттар курсының пәні (1 дәріс)
Процестер және аппараттар курсының пәні (1 дәріс) Типы химических реакций. Решение примеров
Типы химических реакций. Решение примеров Химия в быту
Химия в быту Zirconium Dioxide
Zirconium Dioxide Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Неметаллы. Обобщение и систематизация знаний
Неметаллы. Обобщение и систематизация знаний Химия в загадках
Химия в загадках Алканы. Бутан - С4Н10
Алканы. Бутан - С4Н10 Химический состав молока
Химический состав молока