Содержание
- 2. НАХОЖДЕНИЕ В ТАБЛИЦЕ Хлор -- химический элемент 17-й группы, второго периода периодической системы химических элементов, с
- 3. Физические свойства Температура кипения – (-34)С Температура плавления – (-100)С Плотность – (3,214) г/л Устойчивые степени
- 4. ХИМИЧЕСКИЕ СВОЙСТВА Простое вещество Двухатомный Желтовато-зелёного цвета Тяжелее воздуха С резким запахом и сладковатым «металлическим» вкусом
- 5. Появление на свет Хлороводород был впервые получен Джозефом Пристли в 1772 году. Хлор был получен через
- 6. Появление на свет Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с
- 7. Появление на свет В 1811 г. Дэви предложил для нового элемента название «хлорин» (chlorine). Спустя год
- 8. Горение хлора Хлор реагирует взрывоопасно (или поддерживает горение) многочисленных распространенных материалов. Хлор воспламеняет сталь при 100
- 9. Где находится? В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется
- 10. «АТАКА МЕРТВЕЦОВ» Во время первой мировой войне немецкие войска при задержке у крепости Осовец решили натравить
- 11. Изобретение противогазов
- 12. Реакция человека При остром отравлении хлором в организме происходят сложные биохимические реакции. В частности, соединения хлора,
- 13. Симптомы отравления Проявления отравления хлором легкой степени характеризуются: умеренной головной болью, головокружением. Симптомы при поступлении яда
- 14. Применение В производстве поливинилхлорида, пластикатов, синтетического каучука Для отбеливания тканей, бумаги, картона Производство хлорорганических инсектицидов –
- 15. Если хлор исчезнет? Земля сильно изменится Не будет боевого отравляющего вещества Не будет отбеливателей Исчезнет поваренная
- 16. ТЕСТ Да Нет Хлор легче воздуха?
- 17. Неверно Продолжить
- 18. Верно Хлор тяжелее воздуха.
- 19. ТЕСТ Да Нет Хлор приносит только вред?
- 20. Неверно Продолжить
- 21. Верно Хлор используется в производстве.
- 23. Скачать презентацию



















 Металлы
Металлы Предельные одноатомные спирты
Предельные одноатомные спирты Ocena zawartości mikotoksyn w wybranych produktach spożywczych
Ocena zawartości mikotoksyn w wybranych produktach spożywczych анлекция 3
анлекция 3 10 класс Алкадиены более совершенная (2)
10 класс Алкадиены более совершенная (2) Шаблон презентации по химии
Шаблон презентации по химии Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза
Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Ионные уравнения
Ионные уравнения Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов
Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов Химическое кафе «Кислоты»
Химическое кафе «Кислоты» Рубидий (лат. Rubidium)
Рубидий (лат. Rubidium) Алкины
Алкины Алкадиены
Алкадиены Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны
Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны Презентация по Химии "Введение в органическую химию в тезисах, аргументах и фактах"
Презентация по Химии "Введение в органическую химию в тезисах, аргументах и фактах"  Номенклатура и изомерия аренов
Номенклатура и изомерия аренов Разминка для болельщиков
Разминка для болельщиков Решение задач. Подготовка к контрольной работе по химии
Решение задач. Подготовка к контрольной работе по химии Основные виды сырья для промышленности органического и нефтехимического синтеза
Основные виды сырья для промышленности органического и нефтехимического синтеза Применение ЦОР на уроках биологии и химии
Применение ЦОР на уроках биологии и химии Сера в таблице Д.И. Менделеева
Сера в таблице Д.И. Менделеева Химия и жизнь
Химия и жизнь ВКР: Определение показателей качества мясной и колбасной продукции различных производителей
ВКР: Определение показателей качества мясной и колбасной продукции различных производителей Массовая доля элемента в веществе
Массовая доля элемента в веществе Гидролиз солей
Гидролиз солей Роль нитрадов. Взгляд специалистов
Роль нитрадов. Взгляд специалистов Материаловедение. Легированные стали и сплавы. (Тема 11)
Материаловедение. Легированные стали и сплавы. (Тема 11)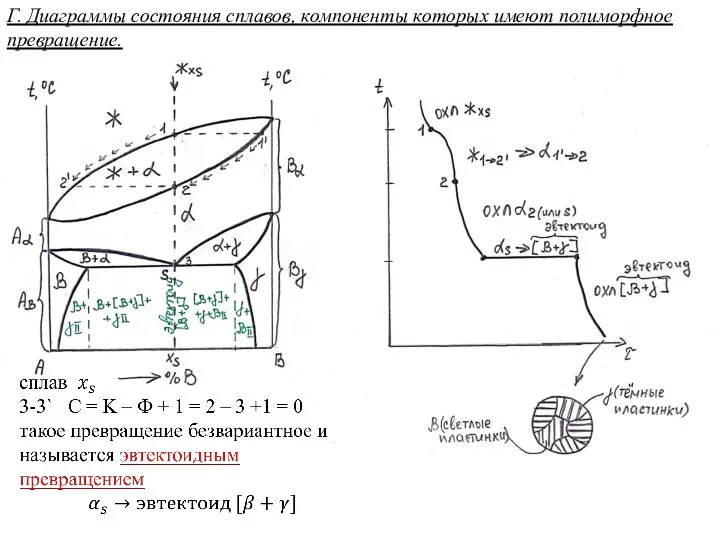 Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение
Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение