Содержание
- 2. Цели урока: Изучение - знаний по определению понятий: химическая связь, ион, ионная связь, металлическая связь; -
- 3. Этапы урока Организационный этап Этап повторения знаний Этап активизации знаний Этап изучения знаний Этап закрепления и
- 4. Повторение Химический диктант по теме «Периодический закон и периодическая система химических элементов Д.И. Менделеева
- 5. Химический диктант. I Вариант Формулировка ПЗХЭ. Что показывает номер периода Что называется группой Что такое неметаллические
- 6. Химическая связь – это взаимодействие электронов, приводящее к образованию устойчивых систем.
- 7. Характеристики связи Длина связи- расстояние между ядрами атомов, образующих молекулу. Энергия связи – энергия, которая необходима
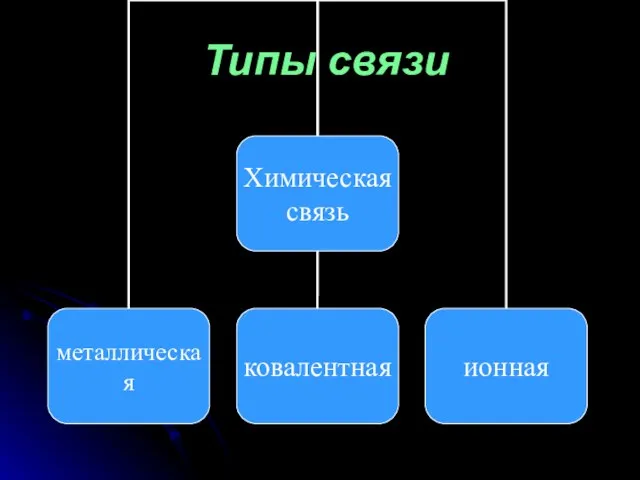
- 8. Типы связи
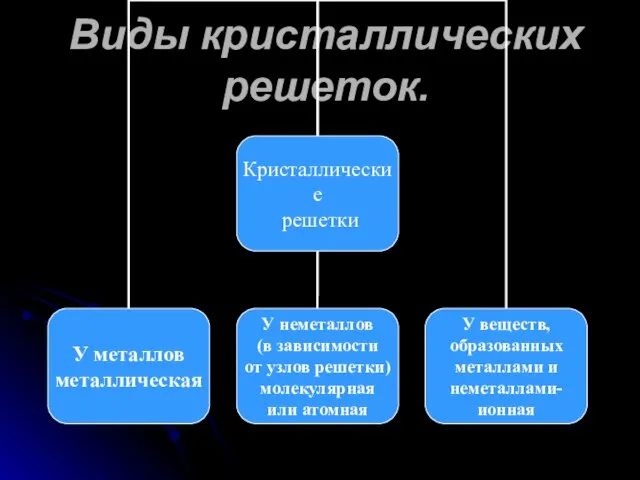
- 9. Виды кристаллических решеток.
- 10. Строение металлов: Металлы имеют на внешнем энергетическом уровне 1,2 электронов. Металлы легко отдают внешние электроны и
- 11. Положительные ионы входят в узлы кристаллической решетки металлов. Электроны находятся внутри решетки, образуя электронный газ. Металлическая
- 12. Общие физические свойства зависят от электронного газа: 1. Пластичность металлов обусловлена тем, что под внешним воздействием
- 13. Общие физические свойства зависят от электронного газа: 3. Для гладкой поверхности металлов характерен серебристо-белый цвет и
- 14. Специфические физические свойства зависят от положительных ионов и атомов в узлах решетки: Если металл активный, то
- 15. Строение неметаллов: Неметаллы имеют на внешнем энергетическом уровне от 4 до 8 электронов. Неметаллы легко принимают
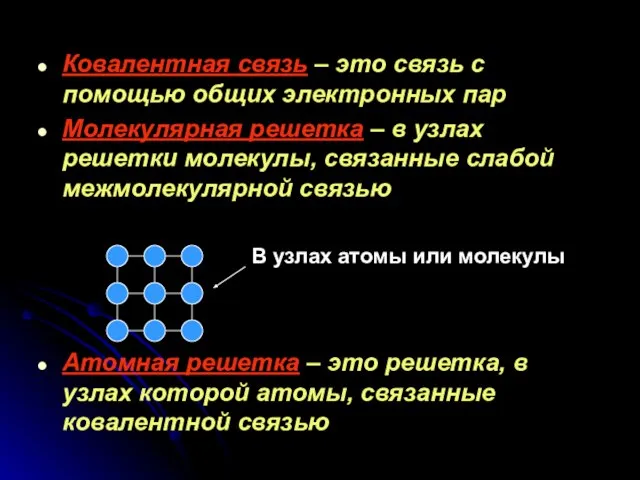
- 16. Ковалентная связь – это связь с помощью общих электронных пар Молекулярная решетка – в узлах решетки
- 17. Физические свойства зависят от молекул или атомов в узлах решетки: Если решетка молекулярная, то вещество непрочное,
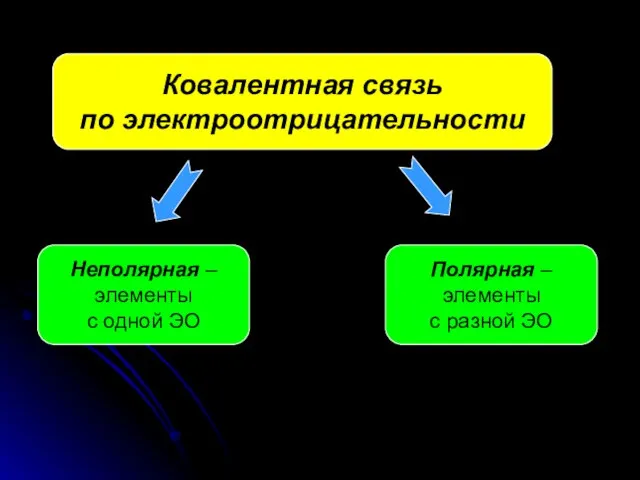
- 18. Ковалентная связь по электроотрицательности Неполярная – элементы с одной ЭО Полярная – элементы с разной ЭО
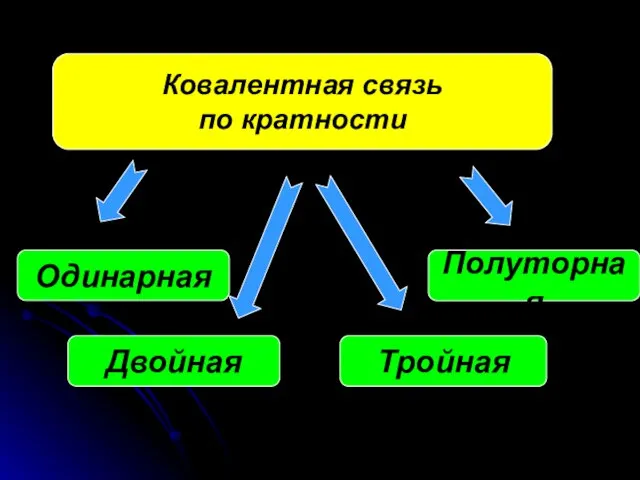
- 19. Ковалентная связь по кратности Одинарная Полуторная Двойная Тройная
- 20. Строение сложных веществ: Металлы легко отдают внешние электроны и превращаться в положительные ионы. Неметаллы принимают электроны
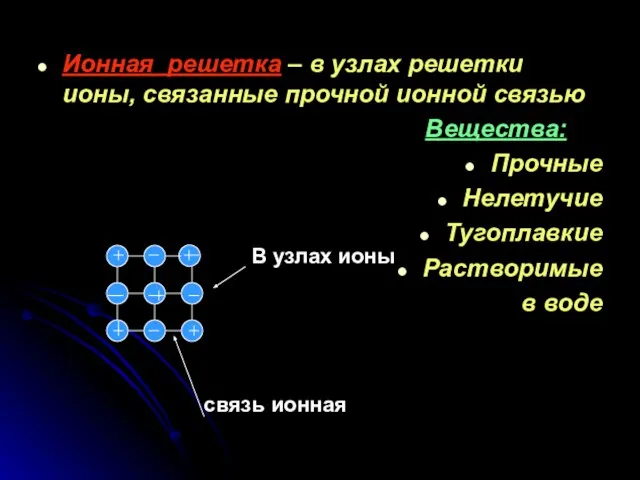
- 21. Ионная решетка – в узлах решетки ионы, связанные прочной ионной связью Вещества: Прочные Нелетучие Тугоплавкие Растворимые
- 22. Закрепление. Определить тип связи, тип кристаллической решетки, физические свойства и уравнение образования связи Железо. Оксид магния.
- 24. Скачать презентацию















 Стекло. Лекция №22
Стекло. Лекция №22 Химическая связь и ее типы
Химическая связь и ее типы Лёгкие металлы
Лёгкие металлы (+)-Plumisclerin A. Плюмисклин А
(+)-Plumisclerin A. Плюмисклин А Основные сведения о металлах и сплавах и их свойства
Основные сведения о металлах и сплавах и их свойства Побочная подгруппа VIII группы
Побочная подгруппа VIII группы Приходченко ФЕР-2031
Приходченко ФЕР-2031 Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров) Тема: «Первоначальные сведения о строении вещества»
Тема: «Первоначальные сведения о строении вещества» Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Химические свойства спиртов и фенола
Химические свойства спиртов и фенола Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Основы химической термодинамики
Основы химической термодинамики Пименов_Химический состав
Пименов_Химический состав 28f89e0351fe4e509cc73515a12a26d5
28f89e0351fe4e509cc73515a12a26d5 lektsia_6 (1)
lektsia_6 (1) Экстракция
Экстракция Спирты
Спирты Строение атома. Экзаменационные вопросы
Строение атома. Экзаменационные вопросы Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Лекция 3
Лекция 3 Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями)
Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями) Мутагены окружающей среды
Мутагены окружающей среды Пептиды, белки. Лабораторное занятие
Пептиды, белки. Лабораторное занятие Демокрит его вклад в развитие взглядов на строение вещества
Демокрит его вклад в развитие взглядов на строение вещества Презентация на тему Дисперсные системы и растворы
Презентация на тему Дисперсные системы и растворы