Содержание
- 2. 30 50 70 120 ЦЕЛЬ УРОКА: дать представление о строении, свойствах, применении азотной кислоты ,особенностях ее
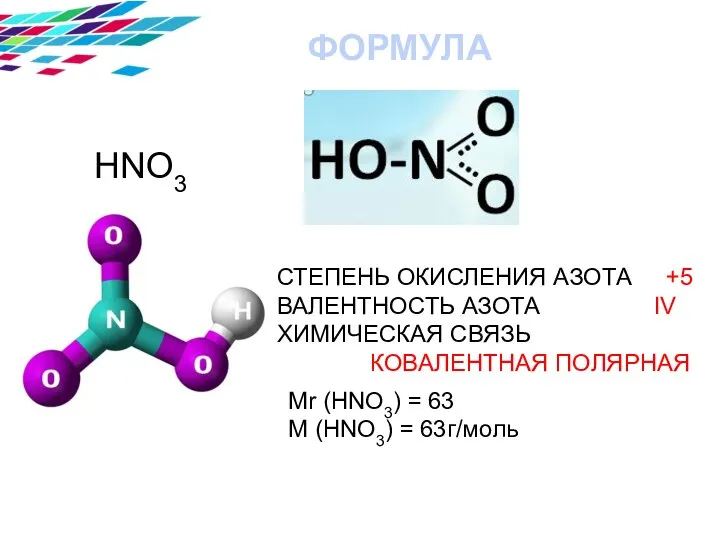
- 3. HNO3 СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА +5 ВАЛЕНТНОСТЬ АЗОТА IV ХИМИЧЕСКАЯ СВЯЗЬ КОВАЛЕНТНАЯ ПОЛЯРНАЯ ФОРМУЛА Mr (HNO3) =
- 4. ИСТОРИЯ ОТКРЫТИЯ Впервые чистую азотную кислоту удалось получить Р. Глауберу в середине XVII в. с помощью
- 5. ПОЛУЧЕНИЕ На производстве: NH3 NO NO2 HNO3 1.Контактное окисление аммиака до оксида азота (II) 4NH3+ 5O2
- 6. ФИЗИЧЕСКИЕ СВОЙСТВА Азотная кислота – бесцветная гигроскопичная жидкость с резким раздражающим запахом, «дымит на воздухе»,неограниченно растворимая
- 7. ХИМИЧЕСКИЕ СВОЙСТВА Общие свойства 1. Действие на индикаторы 2. Диссоциация HNO3 = H+ + NO3- 3.
- 8. ХИМИЧЕСКИЕ СВОЙСТВА Специфические свойства 1. Взаимодействие с металлами
- 9. ХИМИЧЕСКИЕ СВОЙСТВА Специфические свойства 1. Взаимодействие с металлами 4Zn+ 9 HNO3 (разб) = 4Zn(NO3)2 + NH3
- 10. Специфические свойства 2. Разложение на свету или при нагревании 4HNO3 = 4NO2 + O2 + 2H2O
- 11. ПРИМЕНЕНИЕ для получения красителей для получения лекарственных препаратов для получения полимеров при производстве фотопленки для получения
- 12. 3-й класс опасности (умеренно опасная) Вдыхание ее паров приводит к раздражению дыхательных путей. При попадании на
- 13. ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА Выберите, какие из перечисленных свойств характеризуют физические свойства азотной кислоты: Твердое агрегатное состояние;
- 14. ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА 2. Назовите вещества, с которыми может реагировать азотная кислота, запишите соответствующие уравнения реакций:
- 15. ДОМАШНЕЕ ЗАДАНИЕ § 27 (с.92-95), сделать конспект в тетради, тест стр.96 Базовый уровень сложности: с.95 №
- 16. СПАСИБО ЗА УРОК !
- 18. Скачать презентацию














 Общая характеристика неметаллов
Общая характеристика неметаллов Направление процесса. ОВР
Направление процесса. ОВР кулонометрия Дастан
кулонометрия Дастан Презентация на тему Теория строения органических соединений
Презентация на тему Теория строения органических соединений  Презентация на тему Химические антонимы
Презентация на тему Химические антонимы  Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций Органическая химия
Органическая химия Пространственное строение углеводородов
Пространственное строение углеводородов Алканы. Зачетная работа
Алканы. Зачетная работа Таблица Д.И. Менделеева
Таблица Д.И. Менделеева Средства для мытья окон
Средства для мытья окон Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Презентация на тему Аминокислоты
Презентация на тему Аминокислоты  Презентация на тему Кристаллические решетки
Презентация на тему Кристаллические решетки  Lektsia_4_Tochechnye_gruppy_simmetrii_Simvoly_Shenflisa
Lektsia_4_Tochechnye_gruppy_simmetrii_Simvoly_Shenflisa Реакции соединения
Реакции соединения Презентация на тему Использование Икт в преподавании химии
Презентация на тему Использование Икт в преподавании химии  Щелочноземельные металлы
Щелочноземельные металлы Клей
Клей Дигибридное скрещивание.Третий закон Г.Менделя.
Дигибридное скрещивание.Третий закон Г.Менделя. Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Енергетика хімічних реакцій
Енергетика хімічних реакцій Презентация на тему Воздух. Кислород. Горение
Презентация на тему Воздух. Кислород. Горение  Модель Андерсона
Модель Андерсона Блок-схема функциональных элементов клеточного метаболизма
Блок-схема функциональных элементов клеточного метаболизма