Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы
Содержание
- 2. УРАВНЕНИЕ ШРЕДИНГЕРА МОЛЕКУЛЯРНОЙ СИСТЕМЫ В химии широко используются такие понятия, как геометрическая структура молекулы, ее колебания
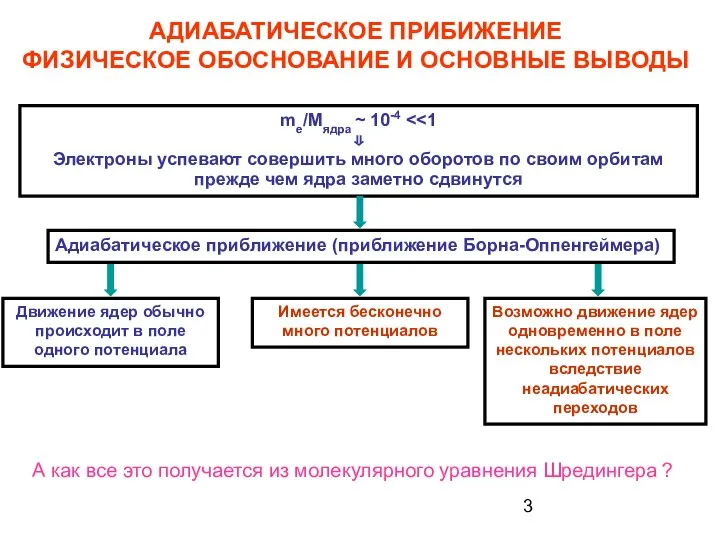
- 3. АДИАБАТИЧЕСКОЕ ПРИБИЖЕНИЕ ФИЗИЧЕСКОЕ ОБОСНОВАНИЕ И ОСНОВНЫЕ ВЫВОДЫ Адиабатическое приближение (приближение Борна-Оппенгеймера) me/Mядра ~ 10-4 ⇓ Электроны
- 4. АДИАБАТИЧЕСКОЕ ПРИБИЖЕНИЕ МАТЕМАТИЧЕСКАЯ ФОРМУЛИРОВКА Полный базисный набор из собственных функций электронного гамильтониана при фиксированных конфигурациях ядер
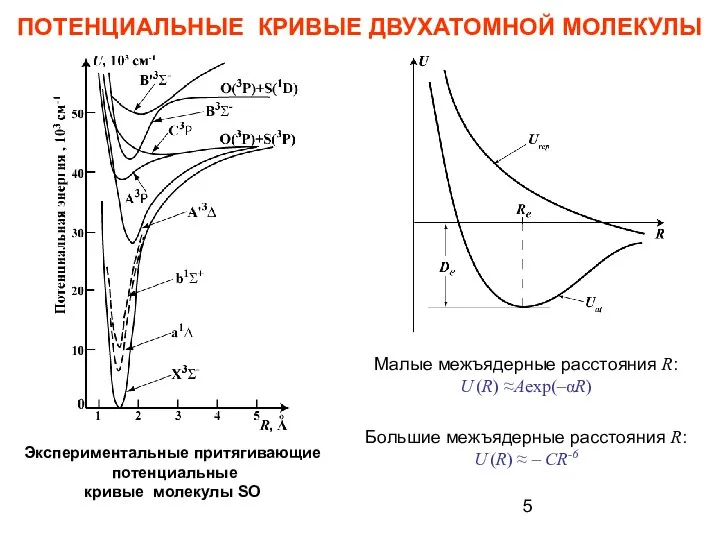
- 5. ПОТЕНЦИАЛЬНЫЕ КРИВЫЕ ДВУХАТОМНОЙ МОЛЕКУЛЫ Экспериментальные притягивающие потенциальные кривые молекулы SO Малые межъядерные расстояния R: U (R)
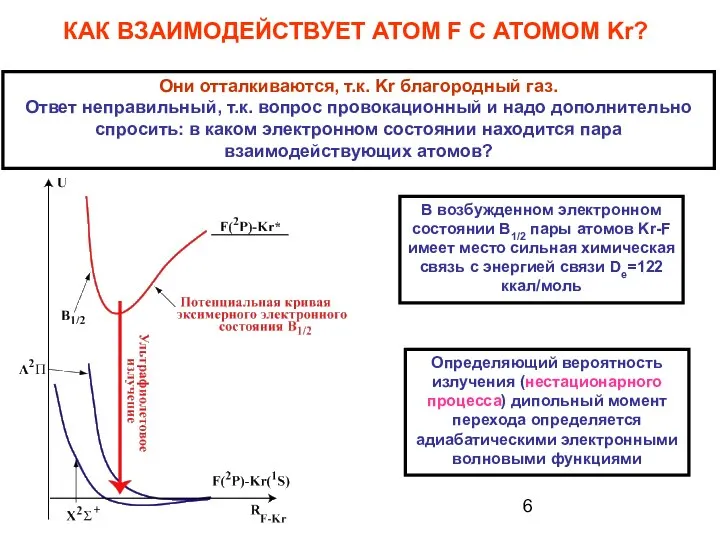
- 6. КАК ВЗАИМОДЕЙСТВУЕТ АТОМ F С АТОМОМ Kr? Они отталкиваются, т.к. Kr благородный газ. Ответ неправильный, т.к.
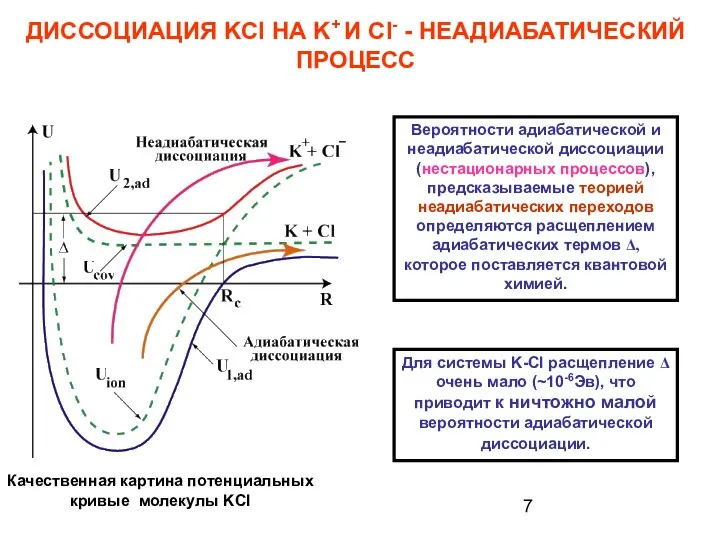
- 7. ДИССОЦИАЦИЯ KCl НА K+ И Cl- - НЕАДИАБАТИЧЕСКИЙ ПРОЦЕСС Вероятности адиабатической и неадиабатической диссоциации (нестационарных процессов),
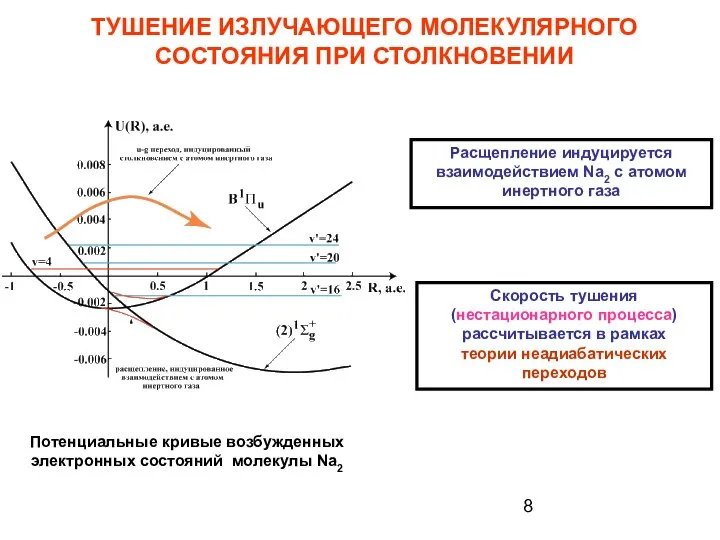
- 8. ТУШЕНИЕ ИЗЛУЧАЮЩЕГО МОЛЕКУЛЯРНОГО СОСТОЯНИЯ ПРИ СТОЛКНОВЕНИИ Расщепление индуцируется взаимодействием Na2 с атомом инертного газа Скорость тушения
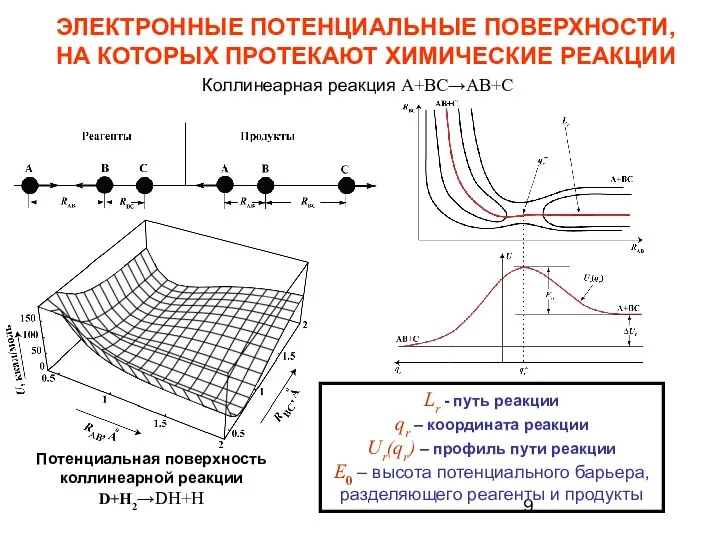
- 9. ЭЛЕКТРОННЫЕ ПОТЕНЦИАЛЬНЫЕ ПОВЕРХНОСТИ, НА КОТОРЫХ ПРОТЕКАЮТ ХИМИЧЕСКИЕ РЕАКЦИИ Lr - путь реакции qr – координата реакции
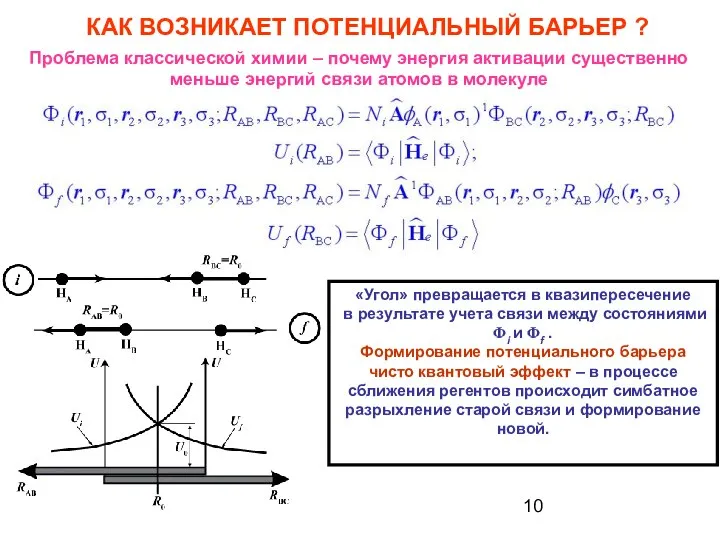
- 10. КАК ВОЗНИКАЕТ ПОТЕНЦИАЛЬНЫЙ БАРЬЕР ? Проблема классической химии – почему энергия активации существенно меньше энергий связи
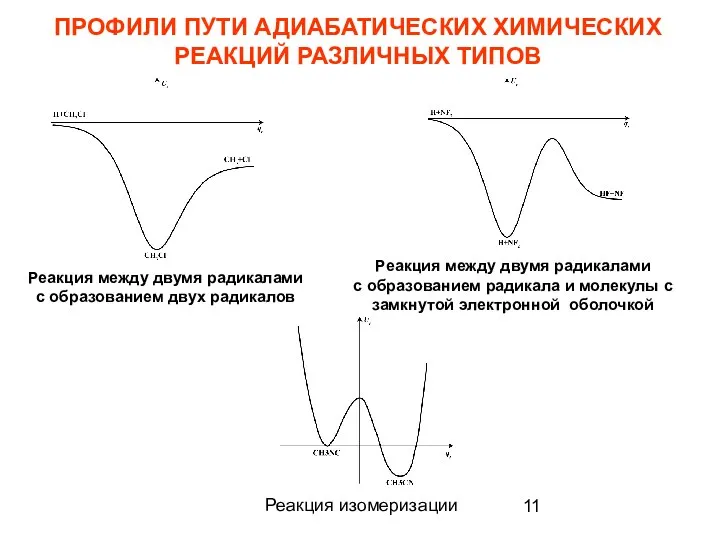
- 11. ПРОФИЛИ ПУТИ АДИАБАТИЧЕСКИХ ХИМИЧЕСКИХ РЕАКЦИЙ РАЗЛИЧНЫХ ТИПОВ Реакция между двумя радикалами с образованием двух радикалов Реакция
- 13. Скачать презентацию


 Строение атома
Строение атома Concise asymmetric total synthesis of lycopodine
Concise asymmetric total synthesis of lycopodine Вирощування кристалів солей
Вирощування кристалів солей Количество вещества. Моль
Количество вещества. Моль Презентация на тему Растворы
Презентация на тему Растворы  Энергетическая диаграмма орбиталей многоэлектронного атома
Энергетическая диаграмма орбиталей многоэлектронного атома Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга
Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга Хлороводород и соляная кислота
Хлороводород и соляная кислота Свойства аренов
Свойства аренов Гидроксильные соединения и их производные
Гидроксильные соединения и их производные Признаки химических реакций
Признаки химических реакций Растворы. Процесс растворения (2)
Растворы. Процесс растворения (2) Строение вещества
Строение вещества Химическая замена
Химическая замена Каучук негізіндегі материалдар
Каучук негізіндегі материалдар Дизельное топливо
Дизельное топливо Приходченко ФЕР-2031
Приходченко ФЕР-2031 Сложные эфиры
Сложные эфиры Сера
Сера Типы химических связей
Типы химических связей Карбоновые кислоты
Карбоновые кислоты Химические реакции
Химические реакции Неметаллы – химические элементы
Неметаллы – химические элементы Алюминий
Алюминий Моделирование строения химических соединений с использованием программного комплекса HyperChem 8.0
Моделирование строения химических соединений с использованием программного комплекса HyperChem 8.0 Строение вещества
Строение вещества Образование дипептида
Образование дипептида Химиялық фармацевтикалық техниканың үдерістері
Химиялық фармацевтикалық техниканың үдерістері